题目内容
4.已知某原电池的电极反应是Fe-2e-═Fe2+,Cu2++2e-═Cu,据此设计该原电池,并回答问题.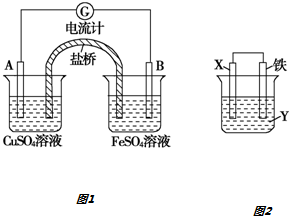
(1)若原电池装置为图1,
①电极材料B是Fe(写名称).
②电流方向是由A到B (填“由A到B”或“由B到A”).
(2)若原电池装置为图2,
①电极材料X可以是b、c(填序号,下同).
a.铁 b.铜 c.石墨
②电解质Y是b、c.
a.FeSO4 b.CuSO4 c.CuCl2.
分析 (1)①含有盐桥的原电池中,电极材料和相对应的电解质溶液具有相同的金属元素;
②电流从正极流向负极;
(2)Fe+Cu2+=Fe2++Cu形成原电池时,Fe为负极,活泼性比Fe弱的金属或导电的非金属为正极,含有铜离子的溶液为电解质溶液.
解答 解:(1)①含有盐桥的原电池中,电极材料和相对应的电解质溶液具有相同的金属元素,所以B电极材料为Fe,
故答案为:Fe;
②电流从正极流向负极,Fe为负极,Cu为正极,则电流由A到B;故答案为:由A到B;
(2)①Fe+Cu2+=Fe2++Cu形成原电池时,Fe为负极,活泼性比Fe弱的金属或导电的非金属为正极,则正极材料可以选用铜或石墨;
故答案为:b、c;
②该原电池中正极上,铜离子得电子,所以含有铜离子的溶液为电解质溶液,电解质可以是CuSO4 或CuCl2,
故答案为:b、c.
点评 本题考查了原电池原理,明确原电池中元素化合价升降与正负极的关系是解本题关键,再结合电子移动方向分析解答,题目难度不大.

练习册系列答案
相关题目
14.氯气溶于水达到平衡后,若只改变某一条件,下列叙述正确的是( )
| A. | 加入少量水,水的电离平衡向正方向移动 | |
| B. | 加入少量NaHCO3固体,c(ClO-)减小 | |
| C. | 通入少量SO2,溶液漂白性增强 | |
| D. | 加入NaOH固体至溶液呈中性时,c(Na+)═c(Cl-)+c(ClO-)+c(HClO) |
13.分离FeCl3、KCl、BaSO4的固体混合物,应采用的一组试剂是( )
| A. | 水、硝酸银溶液、稀硝酸 | B. | 水、氢氧化钠溶液、盐酸 | ||
| C. | 水、氢氧化钾溶液、盐酸 | D. | 水、氢氧化钾溶液、硫酸 |
14. 某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”如图所示,在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗,为使液体顺利流下,还需插入“空气导入管”与大气相通,“空气导入管”下口应在( )
某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”如图所示,在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗,为使液体顺利流下,还需插入“空气导入管”与大气相通,“空气导入管”下口应在( )
 某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”如图所示,在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗,为使液体顺利流下,还需插入“空气导入管”与大气相通,“空气导入管”下口应在( )
某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”如图所示,在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗,为使液体顺利流下,还需插入“空气导入管”与大气相通,“空气导入管”下口应在( )| A. | 滤纸边沿下方 | B. | 滤纸边沿上方 | ||
| C. | 待过滤液液面上方 | D. | 待过滤液中 |
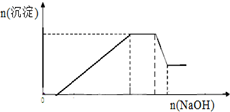 已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:[已知:含Al3+溶液中加氢氧化钠溶液先生成Al(OH)3沉淀,加氢氧化钠溶液过量沉淀会溶解,反应方程式:Al(OH)3+NaOH=NaAlO2+2H2O]
已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:[已知:含Al3+溶液中加氢氧化钠溶液先生成Al(OH)3沉淀,加氢氧化钠溶液过量沉淀会溶解,反应方程式:Al(OH)3+NaOH=NaAlO2+2H2O] (1)如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: 化合物A(C4H10O)是一种有机溶剂.A可以发生以下变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生以下变化: