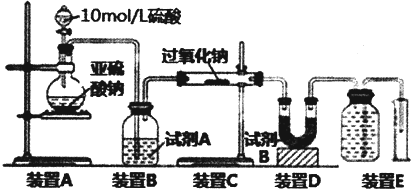
题目内容
12. 已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:[已知:含Al3+溶液中加氢氧化钠溶液先生成Al(OH)3沉淀,加氢氧化钠溶液过量沉淀会溶解,反应方程式:Al(OH)3+NaOH=NaAlO2+2H2O]
已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:[已知:含Al3+溶液中加氢氧化钠溶液先生成Al(OH)3沉淀,加氢氧化钠溶液过量沉淀会溶解,反应方程式:Al(OH)3+NaOH=NaAlO2+2H2O]第一步:加入过量的稀盐酸,无沉淀生成.
第二步:继续加入过量的稀硫酸,有白色沉淀生成.
第三步:过滤,取少量滤液,滴入NaOH溶液至溶
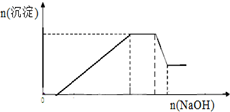
液呈碱性,在此过程中溶液沉淀量的变化如图所示,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体.根据以上实验现象回答下列问题:
(1)该待测液中一定含有Fe2+、Al3+、Ba2+、NH4+、NO3- 离子,一定没有SO42-、Ag+离子
(2)某同学采用测pH的方法来判断滴入NaOH溶液后是否使溶液呈碱性,该实验操作是取一片pH试纸置于表面皿上,用洁净的玻璃棒蘸取待测液,点在pH试纸的中部,与标准比色卡对照,判断溶液是否呈碱性.
(3)第三步中产生使湿润红色石蕊试纸变蓝色的气体的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,该步骤中预期会出现另外一个特殊的实验现象,该现象对应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 加入过量的稀盐酸,无沉淀生成,说明溶液中一定不存在Ag+;
继续加入过量的稀硫酸,有白色沉淀生成,白色沉淀为硫酸钡,原溶液中一定存在Ba2+,则一定不存在SO42-,根据溶液电中性可知,一定存在NO3-;
根据图象可知,加入氢氧化钠溶液后沉淀逐渐增加,然后不变,最后部分溶解,所以一定存在Fe2+、Al3+、NH4+,加热溶液产生使湿润的红色石蕊试纸变蓝色的气体,该气体为氨气,说明溶液中一定存在铵根离子;无法确定溶液中是否存在钾离子,根据以上分析进行解答.
解答 解:(1)加入过量的稀盐酸无沉淀生成,说明溶液中一定不存在与Cl-反应的Ag+;继续加入过量的稀硫酸,有白色沉淀生成,白色沉淀为BaSO4,原溶液中一定存在Ba2+,则一定不存在与Ba2+反应的SO42-,根据溶液电中性可知,一定存在唯一的阴离子NO3-;根据图象可知,加入NaOH溶液后沉淀逐渐增加,然后沉淀的量不变,最后有部分溶解,所以原溶液中一定存在Fe2+、Al3+、NH4+,加热溶液产生使湿润的红色石蕊试纸变蓝色的气体,该气体为氨气,说明溶液中一定存在NH4+,
根据以上分析可知,溶液中一定存在的离子为:Fe2+、Al3+、Ba2+、NH4+、NO3-;一定不存在的离子为:SO42-、Ag+,不能确定K+是否存在,
故答案为:Fe2+、Al3+、Ba2+、NH4+、NO3-;SO42-、Ag+;
(2)所以pH试纸检测定溶液pH的方法为:取一片pH试纸置于表面皿上,用洁净的玻璃棒蘸取待测液,点在pH试纸的中部,与标准比色卡对照,判断溶液是否呈碱性,
故答案为:取一片pH试纸置于表面皿上,用洁净的玻璃棒蘸取待测液,点在pH试纸的中部,与标准比色卡对照,判断溶液是否呈碱性;
(3)使湿润红色石蕊试纸变蓝色的气体为氨气,该反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
溶液中含有亚铁离子,亚铁离子与氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁在加热过程中被氧化成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查了常见离子的检验方法,题目难度中等,要求学生熟练掌握常见离子的检验方法,注意掌握某些离子的特殊性质,如能够使湿润的红色石蕊试纸变蓝的气体为为氨气;本题中硝酸根离子的判断为易错点,注意溶液电中性的应用.

 阅读快车系列答案
阅读快车系列答案| A. | 同温同压下,两种气体的体积之比等于摩尔质量之比 | |
| B. | 同温同压下,两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下,两种气体的摩尔质量之比等于密度之比 | |
| D. | 同温同容下,两种气体的质量之比等于压强之比 |
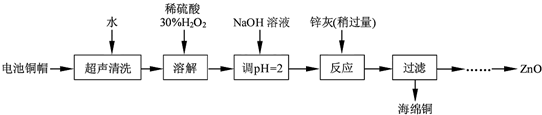
(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为蓝色褪去并半分钟内不恢复.
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入30%H2O2,使其充分反应;
②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
③过滤;
④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
⑤过滤、洗涤、干燥
⑥900℃煅烧.
| A. | 1molNaCl固体溶于1L水所得溶液中NaCl的物质的量浓度为1mol•L-1 | |
| B. | 2.3g钠转化为钠离子时得到的电子数目为0.1NA | |
| C. | 常温常压下,11.2L 甲烷中所含的氢原子数为2NA | |
| D. | 32g O2和O3混合气体所含的原子数目为2NA |
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题