题目内容
11.化合物X的结构简式为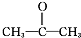 .
.①X分子有1种氢原子.
②X的一种同分异构体Z的结构简式为H2C═CH-CH2OH,请写出Z与Br2发生加成反应的化学方程式:H2C=CH-CH2OH+Br2$\stackrel{催化剂}{→}$H2CBr-CHBr-CH2OH.
分析 ① 中结构对称,只有1种位置的H;
中结构对称,只有1种位置的H;
②Z的结构简式为H2C=CH-CH2OH,含双键,与溴发生加成反应.
解答 解:① 中结构对称,只有1种位置的H,故答案为:1;
中结构对称,只有1种位置的H,故答案为:1;
②Z的结构简式为H2C=CH-CH2OH,含双键,与溴发生加成反应,该反应为H2C=CH-CH2OH+Br2$\stackrel{催化剂}{→}$H2CBr-CHBr-CH2OH,
故答案为:H2C=CH-CH2OH+Br2$\stackrel{催化剂}{→}$H2CBr-CHBr-CH2OH.
点评 本题考查有机物的结构与性质,为高频考点,把握物质分类、官能团、结构对称性、烯烃的性质为解答的关键,注意官能团与性质的关系,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.氢氟酸是一种弱酸,可用来刻蚀玻璃.已知25℃时:
①HF(aq)+OH-(aq)?H2O(l)+F(aq)△H=-67.7kJ/mol
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol
在20Ml0.lmol/L的氢氟酸中滴加0.lmol/L的NaOH V mL,下列说法正确的是( )
①HF(aq)+OH-(aq)?H2O(l)+F(aq)△H=-67.7kJ/mol
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol
在20Ml0.lmol/L的氢氟酸中滴加0.lmol/L的NaOH V mL,下列说法正确的是( )
| A. | 氢氟酸的电离方程式及热效应可表示为:HF(aq)?H+(aq)+F-(aq)△H=+10.4kJ/mol | |
| B. | 当V=20 mL时,溶液中:c(OH-)=c(HF)+c(H+) | |
| C. | 当V=20 mL时,溶液中:c(F-)=c(Na+)=0.1mol/L | |
| D. | 当v>0时,溶液中一定存在c(Na+)>c(F-)>c(OH-)>c(H+) |
2.由于金属锌本身的价值不高,在我国工业锌废料的回收利用率比较低.某课题组研究利用含少量铜、铁的粗锌制备硫酸锌及相关物质的资源综合利用,其工艺流程图(图中加入的物质均为足量)及有关数据如下:
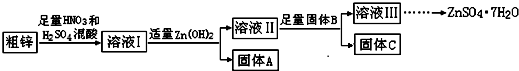
请回答下列问题:
(1)固体A的主要成分是Fe(OH)3;加入固体B的主要作用是将Cu2+(或铜)从溶液Ⅱ中分离出来.
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液II中c(Cu2+)为0.05mol•L-1,则溶液II的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是14.7~14.85g;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=Zn2++H2S↑.
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的Zn(OH)2杂质.

| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
(1)固体A的主要成分是Fe(OH)3;加入固体B的主要作用是将Cu2+(或铜)从溶液Ⅱ中分离出来.
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液II中c(Cu2+)为0.05mol•L-1,则溶液II的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是14.7~14.85g;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=Zn2++H2S↑.
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的Zn(OH)2杂质.
19.由短周期元素形成的化合物A2B3,A3+比B2+少一个电子层,且A3+具有与Ne原子相同的核外电子层结构,下列说法正确的是( )
| A. | A2B3是三氧化二铝 | B. | A3+与B2-最外层上的电子数相同 | ||
| C. | A是第2周期第ⅢA族的元素 | D. | B是第3周期第ⅥA族的元素 |
6.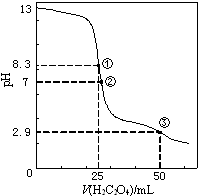 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=c(Na+) | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
16.丰富多彩的颜色变化增添了化学实验的魅力,下列有关反应颜色变化的叙述中正确的是( )
①新制氯水久置后→浅黄绿色消失
②Cl2通入石蕊试液中→先变红后褪色
③SO2通入石蕊试液中→先变红后褪色
④SO2通入品红溶液中→红色褪去
⑤氨气通入酚酞溶液中→红色.
①新制氯水久置后→浅黄绿色消失
②Cl2通入石蕊试液中→先变红后褪色
③SO2通入石蕊试液中→先变红后褪色
④SO2通入品红溶液中→红色褪去
⑤氨气通入酚酞溶液中→红色.
| A. | ①②③④ | B. | ②③④⑤ | C. | ①②④⑤ | D. | 全部 |
3.下列说法不正确的是( )
①质子数相同的粒子一定属于同种元素
②同位素的物理性质有较大差别而化学性质几乎相同
③元素种类由质子数决定,核素种类由质子数和中子数共同决定,元素主要化学性质 由最外层电子数决定
④电子数相同的粒子不一定是同一种元素
⑤每种元素都有两种或两种以上的核素.
①质子数相同的粒子一定属于同种元素
②同位素的物理性质有较大差别而化学性质几乎相同
③元素种类由质子数决定,核素种类由质子数和中子数共同决定,元素主要化学性质 由最外层电子数决定
④电子数相同的粒子不一定是同一种元素
⑤每种元素都有两种或两种以上的核素.
| A. | ①②④ | B. | ③④⑤ | C. | ②③⑤ | D. | ①⑤ |
20.在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol/L和1.5mol/L,现向该溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是( )
| A. | 反应后溶液中H+剩余 1.8mol | |
| B. | 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 | |
| C. | 反应后产生13.44L H2(标准状况) | |
| D. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol |
1.下列有机物名称正确的是( )
| A. | 2-乙基戊烷 | B. | 1,2-二氯丁烷 | ||
| C. | 2,2-二甲基-4-己烯 | D. | 3,4-二甲基辛烷 |