题目内容
8.下列化合物中不存在配位键的是( )| A. | NH4Cl | B. | [Cu(NH3)4]SO4 | C. | [Ag(NH3)2]NO3 | D. | CaCl2 |
分析 含有空轨道的原子或离子与含有孤电子对的原子间能形成配位键,据此分析解答.
解答 解:A.NH4Cl由铵根离子和氯离子构成,铵根离子中氢离子含有空轨道,氮原子含有孤电子对,所以能形成配位键,故A不选;
B.[Cu(NH3)4]SO4由外界离子硫酸根离子和内界离子铜氨络合离子构成,铜氨络合离子中,铜离子含有空轨道,氮原子含有孤电子对,所以铜离子和氨分子能形成配位键,故B不选;
C.[Ag(NH3)2]NO3由外界离子硝酸根离子和内界离子银氨络合离子构成,银氨络合离子中,银离子含有空轨道,氮原子含有孤电子对,所以银离子和氨分子能形成配位键,故C不选;
D.CaCl2电子式为 ,钙离子和氯离子之间只存在离子键,无配位键,故D选;
,钙离子和氯离子之间只存在离子键,无配位键,故D选;
故选D.
点评 本题考查了配合物的成键情况,难度不大,从形成配位键对离子或原子要求的特点来分析解答即可.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
18.下列说法错误的是( )
| A. | 按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-乙基己烷 | |
| B. | 硬脂酸甘油酯和油酸甘油酯互为同系物 | |
| C. | 三硝基甲苯的分子式为C7H5N3O6 | |
| D. | 淀粉与纤维素的化学式为(C6H10O5)n,但两者不是同分异构体 |
19.部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是( )

下列说法正确的是( )
| A. | V=896 | B. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | ||
| C. | 样品中CuO的质量为4.0g | D. | 样品中Fe元素的质量为2.24g |
13.已知有机物A、B之间存在转化关系:A(C6H12O2)+H2O$?_{△}^{稀硫酸}$B+CH3COOH(已配平).则符合条件的B的同分异构体有(不考虑立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
20.决定化学反应在速率的主要因素是( )
| A. | 反应物的性质 | B. | 反应温度 | C. | 浓度 | D. | 压强 |
18.下列工业过程需要石灰石作为原料的是( )
| A. | 氯碱工业 | B. | 高炉炼铁 | C. | 粗硅提纯 | D. | 硫酸工业 |
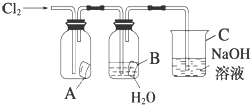 某同学按图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液.请回答下列问题.
某同学按图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液.请回答下列问题.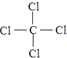 .
.