题目内容
12.下列物质递变规律不能用元素周期律解释的是( )| A. | 金属性:Na>Mg | B. | 热稳定性:HF>HCl | ||
| C. | 酸性:H2SO3>H2CO3 | D. | 氧化性:O2>S |
分析 A.同一周期中,原子序数越大,金属性越强;
B.非金属性越强,氢化物稳定性越强;
C.亚硫酸不是最高价氧化物对应水合物;
D.氧族元素的非金属性氧气,对应单质的氧化性越强.
解答 解:A.Mg、Na位于同一周期,原子序数Na<Mg,根据元素周期律可知金属性:Na>Mg,故A不选;
B.非金属性F>Cl,根据元素周期律可知,氢化物稳定性:HF>HCl,故B不选;
C.H2SO3不是S元素的最高价氧化对应水合物,则无法根据元素周期律判断亚硫酸和碳酸的酸性强弱,故C选;
D.O、S位于同一主族,非金属性O>S,单质的氧化性:O2>S,能够用元素周期律解释,故D不选;
故选C.
点评 本题考查了原子结构与元素周期律的应用,题目难度不大,明确元素周期律内容为解答关键,注意熟练掌握原子结构与元素周期律之间的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
2.在图中的8个装置中,能构成原电池的是( )


| A. | ①③④ | B. | ④⑦ | C. | ④⑥⑦ | D. | ①⑦⑧ |
20.决定化学反应在速率的主要因素是( )
| A. | 反应物的性质 | B. | 反应温度 | C. | 浓度 | D. | 压强 |
7.化学学科需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | CO2分子比例模型: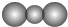 | |
| B. | 中子数为21的钾原子:4019K | |
| C. | NH4I的电子式: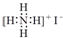 | |
| D. | HCO3-的电离方程式:HCO3-+H2O?H3O++CO32- |
4.核素钬67166Ho的中子数为( )
| A. | 166 | B. | 99 | C. | 67 | D. | 32 |
1.下列有关氰酸铵(NH4CNO)与尿素[CO(NH2)2]的说法正确的是( )
| A. | 都是共价化合物 | B. | 都是离子化合物 | C. | 互为同分异构体 | D. | 互为同系物 |
2.下列离子组在一定条件下能大量共存,且加入相应试剂后发生反应的离子方程式正确的是( )
| 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 | |
| A | K+、AlO2-、NO3- | 过量CO2 | CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- |
| B | ClO-、Fe3+、I- | NaOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | Ca2+、Na+、OH- | NaHCO3溶液 | HCO3-+OH-═CO32-+H2O |
| D | NH4+、HCO3-、Cl- | NaOH溶液 | NH4++HCO3-+2OH-═CO32-+NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
 .
.