题目内容
1.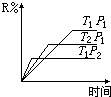 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )| A. | 正反应吸热,S是气体 | B. | 正反应吸热,S是固体 | ||
| C. | 正反应放热,S是气体 | D. | 正反应放热,S是固体或液体 |
分析 由图象可知,同在T1时,根据到达平衡的时间可知P2>P1,同在P1时,根据到达平衡的时间可知T2>T1,根据温度、压强对平衡移动的影响可判断反应热以及S的聚集状态来解答.
解答 解:同在T1时,根据到达平衡的时间可知P2>P1,由图象可知增大压强平衡R的百分含量减小,说明平衡向逆反应方向移动,则说明气体反应物的化学计量数之和小于气体生成物的化学计量数之和,则L为气体,
同在P1时,根据到达平衡的时间可知T2>T1,由图象可知升高温度R的百分含量降低,说明平衡向逆反应方向移动,则正反应为放热反应,
即在该反应中,正反应为放热反应,且S为气体,
故选C.
点评 本题考查化学平衡图象问题,难度不大,本题注意根据图象判断问题、压强的大小,根据温度、压强对平衡移动的影响分析.

练习册系列答案
相关题目
12.下列变化属于化学变化的有( )
①木材干馏制焦炭
②甘油加水作护肤剂
③将溴水滴入CCl4中振荡后褪色
④蛋白质水溶液中加入浓硫酸铵有沉淀析出
⑤用福尔马林溶液浸泡动物的尸体
⑥烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
⑦Na2CO3•10H2O在干燥空气中失水
⑧在Fe(OH)3胶体中加入硅酸溶胶而出现沉淀
⑨电解饱和食盐水制H2、Cl2、NaOH.
①木材干馏制焦炭
②甘油加水作护肤剂
③将溴水滴入CCl4中振荡后褪色
④蛋白质水溶液中加入浓硫酸铵有沉淀析出
⑤用福尔马林溶液浸泡动物的尸体
⑥烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
⑦Na2CO3•10H2O在干燥空气中失水
⑧在Fe(OH)3胶体中加入硅酸溶胶而出现沉淀
⑨电解饱和食盐水制H2、Cl2、NaOH.
| A. | ①②④⑥ | B. | ⑤⑥⑦⑨ | C. | ①⑤⑥⑦⑨ | D. | ②③④ |
12.下列叙述不正确的是( )
| A. | 热水中加入硫酸钠溶解至饱和,此时溶液的pH小于7 | |
| B. | 物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)═c(S2-)+c(HS-)+c(H2S) | |
| C. | pH=13的强碱溶液,加水稀释后,溶液中氢离子的浓度变小 | |
| D. | 25℃时pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,溶液中由水电离产生的氢离子的浓度之比为104 |
9.关于Na2CO3和NaHCO3性质的说法不正确的是( )
| A. | 在水中的溶解性:NaHCO3<Na2CO3 | |
| B. | 相同条件下,与等浓度盐酸反应生成CO2的速率:NaHCO3<Na2CO3 | |
| C. | 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3放出CO2更多 | |
| D. | 等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应产生的CO2质量相同 |
16.现有下列十种物质:①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(2)⑩在水中的电离方程式为Al2(SO4)3=2Al3++2SO42-.
(3)少量的④通入⑥的溶液中反应的离子方程式为CO2+Ba2++2OH-=BaCO3↓+H2O
(4)②与⑨发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6.
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
(3)少量的④通入⑥的溶液中反应的离子方程式为CO2+Ba2++2OH-=BaCO3↓+H2O
(4)②与⑨发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6.
6.中国-094核潜艇上的核反应堆内使用了液体钠铝合金(单质钠和单质铝熔合而成,可看作二者的混合物)做载热介质,将一定质量的合金进行实验,有关说法不正确的是( )
| A. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 | |
| B. | 铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) | |
| C. | 铝钠合金投入足量水中,若放出的H2越多,则铝的质量分数越大 | |
| D. | 铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越大 |
13.下列离子方程式正确的是( )
| A. | 碳酸氢钠溶液与少量石灰水反应:HCO32-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| C. | 醋酸钠溶液和盐酸混合:CH3COONa+H+═CH3COOH+Na+ | |
| D. | 铁跟氯化铁溶液反应:Fe+2Fe3+═3Fe2+ |
9.在水中加入等物质的量的Ag+、Na+、Ba2+、NO3-、SO42-、Cl-,该溶液放在惰性电极的电解槽内,通电一段时间后,则氧化产物与还原产物的质量比为( )
| A. | 35.5:108 | B. | 16:207 | C. | 8:1 | D. | 108:35.5 |
15.下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A. | 0.1mol/L NH4Cl溶液与0.05mol/L NaOH溶液等体积混合后所得的碱性溶液中:c(Cl-)>c(Na+)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) | |
| B. | pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+) | |
| C. | 等物质的量的NaClO、NaHCO5混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |