题目内容
6. CO2经催化加氢可合成乙烯:2CO2 (g)+6H2(g)?C2H4(g)+4H2O(g).0.1MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图.下列叙述不正确的是( )
CO2经催化加氢可合成乙烯:2CO2 (g)+6H2(g)?C2H4(g)+4H2O(g).0.1MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图.下列叙述不正确的是( )| A. | 该反应的△H<O | |
| B. | 曲线b代表H2O | |
| C. | N点和M点所处状态的c(H2)不一样 | |
| D. | 其它条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大 |
分析 A.由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热;
B.可知a为CO2的变化曲线,结合计量数关系可知b为水,c为C2H4的变化曲线;
C.M点和N点都处于平衡状态,n(N2)不变,M点和N点n(N2)相等,据此进行分析;
D.已知该反应正方向为放热反应,其他条件不变,T1℃、0.2 MPa,由于压强增大平衡向逆方向移动,则n(H2)增大,所以n(H2)比上图中M点的值大.
解答 解:A.由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,故△H<O,故A正确;
B.随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线为CO2,由计量数关系可知b为水,c为C2H4的变化曲线,故B正确;
C.M点和N点都处于平衡状态,n(N2)不变,M点和N点n(N2)相等,故C错误;
D.已知该反应正方向为放热反应,其他条件不变,T1℃、0.2 MPa,由于压强增大平衡向逆方向移动,则n(H2)增大,所以n(H2)比上图中M点的值大,故D正确,
故选C.
点评 本题考查化学平衡图象问题,题目难度不大,注意分析图象中各物理量的变化曲线,把握平衡状态的特征为解答该题的关键.

练习册系列答案
相关题目
10.2016年是门捷列夫诞生辰182周年,门捷列夫在化学史上的贡献是( )
| A. | 提出了元素周期律 | B. | 提出了杂化轨道理论 | ||
| C. | 发现了电子 | D. | 发现了能量最低原理 |
11.下列化合物的用途叙述正确的是( )
| A. | 光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材枓主要是SiO2 | |
| B. | 水玻璃可用作防火剂或防腐剂 | |
| C. | 高锰酸钾溶液、SO2、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| D. | SO2可用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
10.下列叙述中正确的是( )
| A. | 由乙酸和乙醇生成乙酸乙酯的反应类型和由乙醇生成乙烯的反应类型相同 | |
| B. | 丙烯在一定条件下可与氯气发生取代反应生成3-氯丙烯 | |
| C. | 硫酸铵和硝酸铅均能使蛋白质变性 | |
| D. | 甲苯与氯气在光照下发生取代反应主要生成2,4-二氯甲苯 |


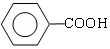
 $→_{②H+}^{①浓KOH、△}$
$→_{②H+}^{①浓KOH、△}$ +
+
 .
. ,该反应的反应类型是缩聚反应.
,该反应的反应类型是缩聚反应. +4Ag(NH3)2++4OH-$\stackrel{△}{→}$
+4Ag(NH3)2++4OH-$\stackrel{△}{→}$ +2NH4++6NH3+4Ag↓+2H2O.
+2NH4++6NH3+4Ag↓+2H2O. 中任意一种.
中任意一种. .
.