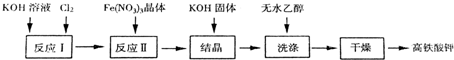
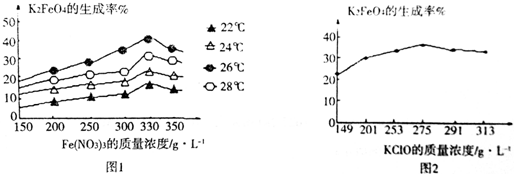
题目内容
16.在标准状况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在碱 式滴定管内,若用甲基橙
作指示剂,达到滴定终点时,溶液从红 色变为橙 色;
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第③种(填序号);
①2.500mol/L ②0.25mol/L ③0.025mol/L
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用C(Na2CO3)表示,滴定时实验数据列表如下:
| 实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
数据和符号列式即可):C(HCl)=$\frac{17.00mL×0.025mol/L×2}{20.00mL}$.
分析 (1)碱性溶液应装在碱式滴定管,酸性、氧化性溶液装在酸性滴定管;盐酸中滴入甲基橙显红色,滴入碳酸钠达到终点时溶液变为橙色;
(2)为减小误差,应尽量用浓度小的溶液;
(3)先判断数据的合理性,求出消耗标准碳酸钠溶液体积,依据Na2CO3-2HCl计算盐酸的物质的量浓度.
解答 解:(1)碳酸钠为强碱弱酸盐,水解显碱性,所以应装在碱式滴定管中;盐酸中滴入甲基橙显红色,滴入碳酸钠达到终点时溶液变为橙色;
故答案为:碱,红,橙;
(2)实验时,为减小实验误差,则所用碳酸钠溶液体积不能过小,否则误差较大,应用浓度最小的,
故答案为:③;
(3)依据表中数据可知第1组数据误差较大,舍弃,则消耗标准液碳酸钠的体积为:$\frac{16.95+17.05}{2}$=17.00mL;
则:Na2CO3 -2HCl
1 2
17.00mL×0.025mol/L C(HCl)×20.00mL
解得:C(HCl)=$\frac{17.00mL×0.025mol/L×2}{20.00mL}$;
故答案为:17.00; $\frac{17.00mL×0.025mol/L×2}{20.00mL}$.
点评 本题考查中和滴定操作、计算,为高频考点,侧重于学生的分析、计算和实验能力的考查,注意把握中和滴定的操作原理和实验方法,难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
12.下列叙述正确的是( )
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,在等体积、等浓度的硝酸中加入氨水,溶液的导电性增强 | |
| C. | 25℃时,0.1mol/L的硫化氢溶液与等浓度的硫化钠溶液的导电能力相当 | |
| D. | 25℃时,将等体积PH=1的盐酸和水混合,混合后溶液的PH=1.3 |
11.用中和滴定法测定烧碱的纯度,准确称取烧碱样品5.0g,将样品配成250mL的待测液,若烧碱中含有不与酸反应的杂质,试根据实验回答:
(1)取10.00mL待测液,用碱式滴定管量取注入锥形瓶中.(填仪器名称)
(2)用0.2000mol•L-1标准盐酸溶液滴定待测烧碱溶液,用酚酞试液作指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶颜色变化,直到滴定终点.达到滴定终点的标志是溶液颜色由红色变为无色,且半分钟保持不变
(3)下列实验操作中,会引起测定结果偏低的(填字母)AC
A.滴定前酸式滴定管下端无气泡,滴定后酸式滴定管下端出现气泡;
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸;
C.滴定时,反应容器摇动太激烈,有少量液体溅出;
D.滴定到终点时,滴定管尖嘴悬有液滴.
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度:0.4000mol•L-1.
(5)根据上述测定数据,分析得到合理数据,计算烧碱的纯度为80%(用百分数表示,保留三位有效数字).
(1)取10.00mL待测液,用碱式滴定管量取注入锥形瓶中.(填仪器名称)
(2)用0.2000mol•L-1标准盐酸溶液滴定待测烧碱溶液,用酚酞试液作指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶颜色变化,直到滴定终点.达到滴定终点的标志是溶液颜色由红色变为无色,且半分钟保持不变
(3)下列实验操作中,会引起测定结果偏低的(填字母)AC
A.滴定前酸式滴定管下端无气泡,滴定后酸式滴定管下端出现气泡;
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸;
C.滴定时,反应容器摇动太激烈,有少量液体溅出;
D.滴定到终点时,滴定管尖嘴悬有液滴.
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度:0.4000mol•L-1.
| 滴定次数 | 待测液体积/mL | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 26.70 |
6.如表是不同温度下水的离子积常数:
试回答以下问题:
(1)90℃时,将pH=3的硫酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=2.05×10-11mol/L(保留三位有效数字).
(2)25℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=90:11;
(3)假设H2SO4是强酸,但常温下0.1mol•L-1H2SO4的溶液中c(H+)=0.11mol•L-1,则Na2SO4溶液呈碱性(填“酸”、“碱”或“中”),0.1mol•L-1的NaHSO4溶液的c(H+)>0.01mol•L-1(填“>”、“<”或“=”) H2SO4溶液与Na2SO4溶液反应的离子方程式为H++SO42-=HSO4-.
(4)25℃时pH=5的H2SO4溶液加水稀释到10倍,则稀释后c(SO42-)与c(H+)的比值为1:2;再加水稀释到100倍,则稀释后c(SO42-)与c(H+)的比值为1:20.
| 温度/℃ | 25 | 90℃ | 100℃ |
| 水的离子积常数 | 1×10-14 | 3.8×10-13 | 1×10-12 |
(1)90℃时,将pH=3的硫酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=2.05×10-11mol/L(保留三位有效数字).
(2)25℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=90:11;
(3)假设H2SO4是强酸,但常温下0.1mol•L-1H2SO4的溶液中c(H+)=0.11mol•L-1,则Na2SO4溶液呈碱性(填“酸”、“碱”或“中”),0.1mol•L-1的NaHSO4溶液的c(H+)>0.01mol•L-1(填“>”、“<”或“=”) H2SO4溶液与Na2SO4溶液反应的离子方程式为H++SO42-=HSO4-.
(4)25℃时pH=5的H2SO4溶液加水稀释到10倍,则稀释后c(SO42-)与c(H+)的比值为1:2;再加水稀释到100倍,则稀释后c(SO42-)与c(H+)的比值为1:20.
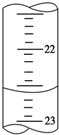 某课外活动小组欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀盐酸,其操作步骤如下:
某课外活动小组欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀盐酸,其操作步骤如下: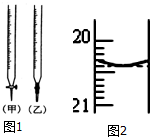 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题: