题目内容
下列实验可行的是( )
| A、将氯化铵溶液蒸干制备氯化铵固体 |
| B、从碘水中提取碘单质,用无水乙醇代替四氯化碳 |
| C、加入适量的铜粉除去硝酸铜溶液中的硝酸银杂质 |
| D、用适量盐酸除去硫酸钠溶液中的碳酸钠 |
考点:化学实验方案的评价
专题:
分析:A.蒸干时氯化铵分解;
B.乙醇与水不分层;
C.Cu与硝酸银反应生成硝酸铜和Ag;
D.盐酸与碳酸钠反应生成氯化钠.
B.乙醇与水不分层;
C.Cu与硝酸银反应生成硝酸铜和Ag;
D.盐酸与碳酸钠反应生成氯化钠.
解答:
解:A.蒸干时氯化铵分解,不能制备氯化铵,应选结晶法制备,故A错误;
B.乙醇与水不分层,不能作萃取剂,故B错误;
C.Cu与硝酸银反应生成硝酸铜和Ag,则加入适量的铜粉除去硝酸铜溶液中的硝酸银杂质,故C正确;
D.盐酸与碳酸钠反应生成氯化钠,引入新杂质,应选硫酸除杂,故D错误;
故选C.
B.乙醇与水不分层,不能作萃取剂,故B错误;
C.Cu与硝酸银反应生成硝酸铜和Ag,则加入适量的铜粉除去硝酸铜溶液中的硝酸银杂质,故C正确;
D.盐酸与碳酸钠反应生成氯化钠,引入新杂质,应选硫酸除杂,故D错误;
故选C.
点评:本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯等为解答的关键,侧重物质性质及实验基本技能的考查,题目难度不大.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
下列有关二氧化硫的叙述中,正确的是( )
| A、二氧化硫与水反应生成硫酸 |
| B、二氧化硫是酸性氧化物,能被氨水吸收 |
| C、二氧化硫是有毒气体,不能用于杀菌消毒 |
| D、正常雨水的pH为5.6,因为其中溶解了二氧化硫 |
下列有关实验装置(部分夹持装置已省略)进行的相应实验,能达到实验目的是( )
A、 用图所示装置可制取Cl2 |
B、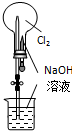 用图所示装置可完成“喷泉”实验 |
C、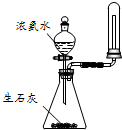 用图所示装置可制取并收集干燥纯净的NH3 |
D、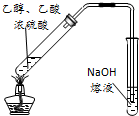 用图所示装置可用于实验室制取乙酸乙酯 |
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的容器中,发生反应:2SO2+O2?2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是( )
| A、2 mol SO2+1 mol O2 |
| B、1mol SO2+1 mol O2 |
| C、2 mol SO2+1 mol O2+2 mol SO3 |
| D、1 mol SO2+1 mol SO3 |
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A、所用NaOH已吸潮 |
| B、容量瓶未干燥 |
| C、烧杯内有少量NaOH溶液残留 |
| D、定容时俯视液面 |
下列高分子材料中属于线性结构的是( )
| A、聚丙烯 | B、硫化橡胶 |
| C、电木 | D、有机玻璃 |
下列用来表示物质变化的化学用语中,正确的是( )
| A、钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
| B、HS-的水解方程式:HS-+H2O?S2-+H3O+ |
| C、CO32-的水解方程式:CO32-+H2O?HCO3-+OH- |
| D、AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32-═Al2(CO3)3↓ |
 I.水的电离平衡曲线如图所示,根据图中数据,回答下列问题:
I.水的电离平衡曲线如图所示,根据图中数据,回答下列问题: