题目内容
下列有关二氧化硫的叙述中,正确的是( )
| A、二氧化硫与水反应生成硫酸 |
| B、二氧化硫是酸性氧化物,能被氨水吸收 |
| C、二氧化硫是有毒气体,不能用于杀菌消毒 |
| D、正常雨水的pH为5.6,因为其中溶解了二氧化硫 |
考点:二氧化硫的化学性质
专题:
分析:A、二氧化硫和水反应生成亚硫酸;
B、酸性氧化物和碱发生反应;
C、二氧化硫可用于非食品业的杀菌消毒;
D、正常雨水溶解二氧化碳而使其溶液pH=5.6.
B、酸性氧化物和碱发生反应;
C、二氧化硫可用于非食品业的杀菌消毒;
D、正常雨水溶解二氧化碳而使其溶液pH=5.6.
解答:
解:A、二氧化硫和水反应生成亚硫酸,亚硫酸被氧气氧化才能生成硫酸,故A错误;
B、SO2和碱反应只生成盐和水,所以属于酸性氧化物,和氨水反应生成亚硫酸铵,故B正确;
C、病毒属于蛋白质,能被二氧化硫杀死而发生蛋白质变性,所以二氧化硫能杀菌消毒,故C错误;
D、二氧化碳和水反应生成碳酸,碳酸电离出氢离子而使雨水溶液呈酸性,其pH=5.6,如果溶解了二氧化硫,二氧化硫和水反应生成亚硫酸,亚硫酸不稳定易被氧气氧化生成硫酸,其酸性增强,pH小于5.6,故D错误;
故选B.
B、SO2和碱反应只生成盐和水,所以属于酸性氧化物,和氨水反应生成亚硫酸铵,故B正确;
C、病毒属于蛋白质,能被二氧化硫杀死而发生蛋白质变性,所以二氧化硫能杀菌消毒,故C错误;
D、二氧化碳和水反应生成碳酸,碳酸电离出氢离子而使雨水溶液呈酸性,其pH=5.6,如果溶解了二氧化硫,二氧化硫和水反应生成亚硫酸,亚硫酸不稳定易被氧气氧化生成硫酸,其酸性增强,pH小于5.6,故D错误;
故选B.
点评:本题考查了二氧化硫的漂白性、溶解性等知识点,根据酸性氧化物的概念、酸雨的形成、二氧化硫的漂白性来分析解答即可,知道正常雨水pH不为7的原因,明确二氧化硫和次氯酸漂白性原理的差别,题目难度不大.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
食品添加剂让食品变得丰富多彩,但应正确使用食品添加剂.做馒头的过程中不能添加的是( )
| A、增白剂 | B、蔗糖 |
| C、小苏打 | D、食盐 |
下列说法中正确的是( )
| A、近期媒体报道的某白酒中的增塑剂是对人体健康无害的物质 |
| B、尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”的宗旨 |
| C、垃圾是放错地方的资源,应分类回收利用 |
| D、光化学烟雾、酸雨等可能与PM2.5的存在有关 |
下列实验可行的是( )
| A、将氯化铵溶液蒸干制备氯化铵固体 |
| B、从碘水中提取碘单质,用无水乙醇代替四氯化碳 |
| C、加入适量的铜粉除去硝酸铜溶液中的硝酸银杂质 |
| D、用适量盐酸除去硫酸钠溶液中的碳酸钠 |
化合物丙由如下反应制得:C4H
O
C4H
C4H
Br.丙的结构简式不可能的是( )
10 甲 |
| 浓硫酸,△ |
| 或Al2O4,△ |
8 乙 |
| Br2 |
| 溶液CCl4 |
8 丙 |
| A、CH3CH2CHBrCH2Br |
| B、CH3CH(CH2Br)2 |
| C、CH3CHBrCHBrCH3 |
| D、(CH3)2CBrCH2Br |
在室温下,某溶液中由水电离出的H+浓度为1.0×10-13 mol?L-1,则此溶液中一定能大量存在的离子组是( )
| A、Fe3+、NO3-、Cl-、Na+ |
| B、Ca2+、HCO3-、Cl-、K+ |
| C、NH4+、Fe2+、SO42-、NO3- |
| D、Cl-、SO42-、K+、Na+ |
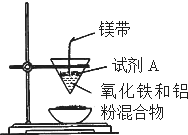 某小组进行铝热反应实验,装置如图所示.
某小组进行铝热反应实验,装置如图所示.
