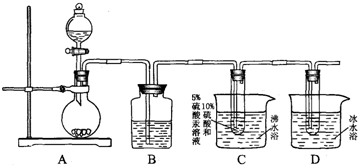
题目内容
某食盐中碘的添加剂为KIO5,称取m克该食盐溶于水配成500mL溶液.取50mL该溶液加足量KI溶液并用稀H2SO4酸化,此时发生的反应为:IO5-+5I-+6H+=3I2+3H20,然后调整溶液的酸度,加淀粉做指示剂,足滴加入0.1mol?L-1Na2S2O5溶液,当消耗aL溶液时,指示剂变色,反应完全.方程式为I2+2S2O52-=2I-+S4O62-,求碘盐中碘元素的质量分数.
考点:离子方程式的有关计算
专题:
分析:根据反应I2+2S2O52-=2I-+S4O62-、IO5-+5I-+6H+=3I2+3H20找出IO5-与S2O52-关系式,然后根据n=cV及反应关系式计算出滴定50mL样品溶液消耗IO5-的物质的量,再计算出500mL样品溶液中含有的KIO5的物质的量,再计算出碘盐中碘元素的质量分数.
解答:
解:根据反应I2+2S2O52-=2I-+S4O62-、IO5-+5I-+6H+=3I2+3H20可得关系式:IO5-~3I2~6S2O52-,
aL 0.1mol?L-1Na2S2O5溶液总共含有Na2S2O5的物质的量为:0.1mol/L×aL=0.1amol,
500mL样品溶液消耗Na2S2O5的物质的量为:0.1amol×
=amol,
根据关系式IO5-~3I2~6S2O52-可得,mg该食盐中含有的n(KIO5)=n(IO5-)=6n(S2O52-)=6amol,
所以碘盐中碘元素的质量分数为:
×100%=
,
答:碘盐中碘元素的质量分数为
.
aL 0.1mol?L-1Na2S2O5溶液总共含有Na2S2O5的物质的量为:0.1mol/L×aL=0.1amol,
500mL样品溶液消耗Na2S2O5的物质的量为:0.1amol×
| 500mL |
| 50mL |
根据关系式IO5-~3I2~6S2O52-可得,mg该食盐中含有的n(KIO5)=n(IO5-)=6n(S2O52-)=6amol,
所以碘盐中碘元素的质量分数为:
| 246g/mol×amol |
| mg |
| 246a |
| m |
答:碘盐中碘元素的质量分数为
| 246a |
| m |
点评:本题考查了中和滴定中离子反应的计算,题目难度中等,根据反应方程式找出关系式为解答关键,试题有利于培养学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
同主族元素形成的同一类型化合物,往往其结构和性质相似.化合物PH4I是一种无色晶体,下列对它的描述正确的是( )
| A、它是一种共价化合物 |
| B、在加热条件下不能产生有色气体 |
| C、它能与NaOH溶液反应 |
| D、该化合物中每个原子都能满足8电子稳定结构 |
下列实验过程中,始终无明显现象的是( )
| A、NH3通入FeSO4溶液中 |
| B、CO2通入CaCl2溶液中 |
| C、AlCl3溶液中滴入NaHCO3溶液 |
| D、SO2通入Ba(NO3)2溶液中 |
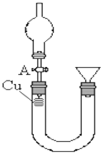 某研究性学习小组设计实验方案来研究稀硝酸与铜反应生成NO.
某研究性学习小组设计实验方案来研究稀硝酸与铜反应生成NO.
 ,则乙炔和水加成的化学方程式是
,则乙炔和水加成的化学方程式是