题目内容
(1)“向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液.”在以上叙述中发生的反应有(写离子方程式):(可不填满,也可继续添加)①、 ②、 ③ ,④
(2)现有部分短周期元素的性质或原子结构如下表:

①元素T的原子核外共有 种不同运动状态的电子.写出X原子的电子排布图
②元素Y与氢元素形成一种离子YH4+,写出该微粒的结构式(标出其中的配位键) ,其中心原子的原子轨道杂化方式为 杂化,发生水解反应的离子方程式
③元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 .
a.常温下Z的单质和T的单质状态不同
b.氢化物稳定性 Z>T
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.氢化物水溶液酸性Z>T
e.最高价氧化物对应的水化物酸性 Z>T.
(2)现有部分短周期元素的性质或原子结构如下表:

①元素T的原子核外共有
②元素Y与氢元素形成一种离子YH4+,写出该微粒的结构式(标出其中的配位键)
③元素Z与元素T相比,非金属性较强的是
a.常温下Z的单质和T的单质状态不同
b.氢化物稳定性 Z>T
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.氢化物水溶液酸性Z>T
e.最高价氧化物对应的水化物酸性 Z>T.
考点:原子轨道杂化方式及杂化类型判断,非金属在元素周期表中的位置及其性质递变的规律,配合物的成键情况
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)硫酸铜先和氨水反应生成氢氧化铜,氢氧化铜和氨水反应生成络合物,根据反应写出离子反应方程式;根据胆矾溶液与足量氨水形成的深蓝色溶液中的阳离子为四氨合铜络离子;
(2)短周期元素T的M层上有6个电子,T为S;X的最外层电子数是次外层的2倍,X为C;氢化物水溶液呈碱性的气体为氨气,故Y为N;Z的最高正价为+7,所以Z为Cl,依此解答.
(2)短周期元素T的M层上有6个电子,T为S;X的最外层电子数是次外层的2倍,X为C;氢化物水溶液呈碱性的气体为氨气,故Y为N;Z的最高正价为+7,所以Z为Cl,依此解答.
解答:
解:(1)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-;
故答案为:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-;
(2)短周期元素T的M层上有6个电子,T为S;X的最外层电子数是次外层的2倍,X为C;氢化物水溶液呈碱性的气体为氨气,故Y为N;Z的最高正价为+7,所以Z为Cl,
①T为S,其原子核外有16个电子,每一个电子的运动状态均不同,故其核外共有16种不同运动状态的电子.X为C,其原子的电子排布图为 ;
;
故答案为:16; ;
;
②NH4+中N原子含有3个共价单键和一个配位键,H离子含有空轨道,N原子含有孤电子对,所以二者形成一个配位键,所以结构式为: ;
;
N原子的价电子对数=4+
=4,所以N原子的杂化方式为sp3;
NH4+水解生成一水合氨和氢离子,水解离子方程式为NH4++H2O?NH3?H2O+H+;
故答案为: ;sp3;NH4++H2O?NH3?H2O+H+;
;sp3;NH4++H2O?NH3?H2O+H+;
③Cl的非金属性比S的强,
a.常温下Z的单质和T的单质状态不同,和分子间作用力有关,和元素非金属性无关,故a错误;
b.氢化物稳定性 Z>T,氢化物稳定性越强,元素非金属性越强,故b正确;
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应,不能证明Cl的非金属性比S的强,故c错误;
d.元素最高价氧化物水化物酸性越强,非金属性越强,氢化物水溶液酸性Z>T,不能证明Cl的非金属性比S的强,故d错误;
e.元素最高价氧化物水化物酸性越强,非金属性越强,最高价氧化物对应的水化物酸性 Z>T,故e正确.
故答案为:Cl;be.
故答案为:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-;
(2)短周期元素T的M层上有6个电子,T为S;X的最外层电子数是次外层的2倍,X为C;氢化物水溶液呈碱性的气体为氨气,故Y为N;Z的最高正价为+7,所以Z为Cl,
①T为S,其原子核外有16个电子,每一个电子的运动状态均不同,故其核外共有16种不同运动状态的电子.X为C,其原子的电子排布图为
 ;
;故答案为:16;
 ;
;②NH4+中N原子含有3个共价单键和一个配位键,H离子含有空轨道,N原子含有孤电子对,所以二者形成一个配位键,所以结构式为:
 ;
;N原子的价电子对数=4+
| 5-1-1×4 |
| 2 |
NH4+水解生成一水合氨和氢离子,水解离子方程式为NH4++H2O?NH3?H2O+H+;
故答案为:
 ;sp3;NH4++H2O?NH3?H2O+H+;
;sp3;NH4++H2O?NH3?H2O+H+;③Cl的非金属性比S的强,
a.常温下Z的单质和T的单质状态不同,和分子间作用力有关,和元素非金属性无关,故a错误;
b.氢化物稳定性 Z>T,氢化物稳定性越强,元素非金属性越强,故b正确;
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应,不能证明Cl的非金属性比S的强,故c错误;
d.元素最高价氧化物水化物酸性越强,非金属性越强,氢化物水溶液酸性Z>T,不能证明Cl的非金属性比S的强,故d错误;
e.元素最高价氧化物水化物酸性越强,非金属性越强,最高价氧化物对应的水化物酸性 Z>T,故e正确.
故答案为:Cl;be.
点评:本题考查了配合物的离子方程式的书写、杂化方式的判断、电子排布图等知识点,配合物中判断提供空轨道和孤对电子的原子是关键.

练习册系列答案
相关题目
下图为向25ml0.1mol/LNaOH溶液中逐滴0.2mol/L醋酸溶液,曲线如下图所示,在AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
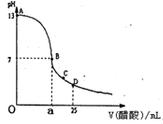

| A、c(OH-)一定大于c(CH3COO-) |
| B、c(OH-)一定小于c(CH3COO-) |
| C、c(OH-)一定等于c(CH3COO-) |
| D、上述三种情况都可能 |
用胆矾(CuSO4?5H2O)晶体配制0.1mol/L的CuSO4溶液500mL,下列方法正确的是( )
| A、称取8.0g胆矾使其溶于500mL水中 |
| B、称取12.5g胆矾使其溶于500mL水中 |
| C、称取12.5g胆矾使其溶于适量水中,再加水稀释至500mL. |
| D、称取8.0g胆矾使其溶于375g水中 |
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是( )
| A、CuCl2(CuO) |
| B、NaCl(HCl) |
| C、NaOH(NaOH) |
| D、CuSO4[Cu(OH)2] |