题目内容
3.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 常温下,44gCO2含有NA个C原子 | |
| B. | 1 L0.1mol•L-1Na2S溶液中含有0.1NA个S2- | |
| C. | 0.1mol Na与足量O2反应,转移0.2NA个电子 | |
| D. | 标准状况下,22.4L的CCl4含有4NA个Cl原子 |
分析 A、求出二氧化碳的物质的量,然后根据二氧化碳中含1个碳原子来分析;
B、硫离子为弱碱阴离子,在溶液中会水解;
C、钠反应后变为+1价;
D、标况下四氯化碳为液态.
解答 解:A、44g二氧化碳的物质的量为1mol,而二氧化碳中含1个碳原子,故1mol二氧化碳中含NA个碳原子,故A正确;
B、硫离子为弱碱阴离子,在溶液中会水解,故溶液中硫离子的个数小于0.1NA个,故B错误;
C、钠反应后变为+1价,故0.1mol钠反应后转移0.1NA个电子,故C错误;
D、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和含有的氯原子的个数,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案
相关题目
12.在一密闭容器中,一定条件下发生反应A+3B?2C,在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则用B浓度的变化表示的该反应在这段时间内的平均反应速率为( )
| A. | 0.04 mol/(L•s) | B. | 0.12 mol/(L•s) | C. | 0.4 mol/(L•s) | D. | 1.2 mol/(L•s) |
10.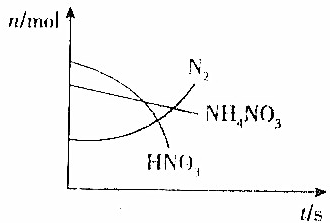 某容器中发生一个化学反应,反应过程中存在Zn、H2O、HNO3、N2、NH4NO3和Zn(NO3)2六种物质,在反应过程中测得HNO3、NH4NO3和N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )
某容器中发生一个化学反应,反应过程中存在Zn、H2O、HNO3、N2、NH4NO3和Zn(NO3)2六种物质,在反应过程中测得HNO3、NH4NO3和N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )
 某容器中发生一个化学反应,反应过程中存在Zn、H2O、HNO3、N2、NH4NO3和Zn(NO3)2六种物质,在反应过程中测得HNO3、NH4NO3和N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )
某容器中发生一个化学反应,反应过程中存在Zn、H2O、HNO3、N2、NH4NO3和Zn(NO3)2六种物质,在反应过程中测得HNO3、NH4NO3和N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )| A. | N2是还原产物,Zn(NO3)2是氧化产物 | |
| B. | NH4NO3是氧化剂,Zn是还原剂 | |
| C. | 反应生成1molN2时共有5mol电子转移 | |
| D. | HNO3在反应中没有表现出酸性 |
12.设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| B. | 标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数等于2NA | |
| C. | NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA | |
| D. | 1 mol Fe在氧气中充分燃烧失去3NA个电子 |
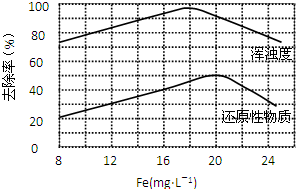 FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:
FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题: 为合成某种液晶材料的中间体M,有人提出如下不同的合成路径:
为合成某种液晶材料的中间体M,有人提出如下不同的合成路径: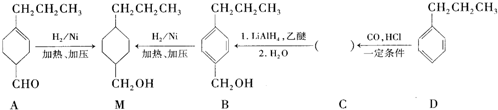
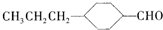 和
和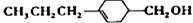 (写结构简式)生成.
(写结构简式)生成.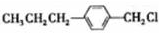 .
. .
. 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
 .
. .
.