题目内容
19.实验室需要0.1mol•L-1NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:(1)如图所示的仪器中配制溶液肯定不需要的是AC(填序号),配制上述溶液还需用到的玻璃仪器是玻璃棒、烧杯(填仪器名称).
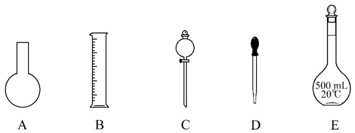
(2)下列操作中,容量瓶所不具备的功能有BCDE(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为2.0g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度小于0.1mol•L-1(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时未经冷却,则所得溶液浓度大于0.1mol•L-1.
(4)根据计算得知,所需质量分数为98%、密度为1.84g•cm-3的浓硫酸的体积为13.6mL(计算结果保留一位小数).
分析 (1)根据配制一定物质的量浓度溶液用到仪器选择;根据配制溶液的体积选择容量瓶的规格;
(2)容量瓶为配制特定体积的一定物质的量浓度溶液的专用仪器,不能稀释浓溶液、不能用于溶解固体、储存溶液、不能用来加热溶解固体溶质等;
(3)根据n=cVm计算需要氢氧化钠的质量;分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸体积
解答 解:(1)配制一定物质的量浓度溶液用的仪器有:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,不需要的仪器有烧杯和分液漏斗,要配制450ml溶液应选择500ml容量瓶;还缺少的玻璃仪器:玻璃棒、烧杯;
故答案为:AC;玻璃棒、烧杯;
(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能储存溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,
故选BCDE;
(3)0.1mol•L-1NaOH溶液450mL,应选500mL容量瓶,实际配制500mL溶液,需要氢氧化钠质量m=0.1mol/L×0.5L×40g/mol=2.0g;在实验中其他操作均正确,若定容时仰视刻度线,导致溶液体积偏大,则所得溶液浓度小于0.1mol•L-1;氢氧化钠溶解产生大量的热,若NaOH溶液在转移至容量瓶时未经冷却,冷却后溶液体积偏小,则所得溶液浓度大于0.1mol•L-1;
故答案为:2.0;小于;大于;
(4)质量分数为98%密度为1.84g/mL的硫酸物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L;设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=500mL×0.5mol/L,解得V=13.6mL;
故答案为:13.6.
点评 本题主要考查一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶规格选择及使用方法和注意事项,注意误差分析的方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 2:1:2:1 | B. | 1:2:1:2 | C. | 4:2:2:1 | D. | 1:2:2:1 |
| A. | Al溶于某强酸失去2mol电子,一定产生2gH2 | |
| B. | 0.1mol肼(N2H4)中共用电子对教目为0.5NA | |
| C. | 64.0gSO2与足量O2生成SO3电子转移教为2NA | |
| D. | 2L0.5mol/L硫酸钾溶液阴离子电荷数为2NA |
(1)若因为反应中有放热现象,而造成少量HCl在反应中挥发,则测得的中和热偏小(填“偏大”“偏小”或“不变”).
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
| 实验 序号 | 起始温度t1/℃ | 终止温度 (t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会偏小(填“偏大”“偏小”或“不变”),其原因是醋酸为弱酸,电离过程为吸热过程.
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热的数值偏小(填“偏大”“偏小”或“不变”).
| A. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 | |
| B. | 温度、压强一定时,吸热的熵增反应一定能够自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 固体的溶解过程与熵变无关 |
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类数相同 | |
| B. | 乙烷、苯、裂化汽油溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | Na在Cl2中燃烧的生成物含离子键,所以NaCl固体可导电 | |
| D. | 乙醇的沸点比乙酸的沸点低,所以乙醇和乙酸可通过蒸馏初步分离 |
| A. | 它们都含有碳、而且碳原子有四个价电子,碳原子间以及碳与其他原子间结构多样 | |
| B. | 它们反应很复杂 | |
| C. | 制取它们的方法很多 | |
| D. | 它们都是非电解质 |