题目内容
10.欲配制490mL 0.2mol/L Na2CO3溶液,需要用天平称量Na2CO3•10H2O晶体质量为28.6g.从配好的上述溶液中取出10mL溶液加水稀释至20mL,则此溶液中Na+的物质的量浓度为0.2mol/L.分析 欲配制490mL 0.2mol/L Na2CO3溶液,实际上配制的是500mL 0.2mol/L的碳酸钠溶液;根据n=cV计算碳酸钠物质的量,根据m=nM计算Na2CO3•10H2O的质量,然后根据稀释定律计算稀释后溶液中Na+的物质的量浓度.
解答 解:欲配制490mL 0.2mol/L Na2CO3溶液,实际上配制的是500mL 0.2mol/L的碳酸钠溶液,
500mL 0.2mol/L的碳酸钠溶液中含有碳酸钠物质的量为:0.5L×0.2mol/L=0.1mol,需要Na2CO3•10H2O的质量为:0.1mol×286g/mol=28.6g;
根据稀释定律,稀释后溶液中Na+的物质的量浓度为:$\frac{0.2mol/L×2×0.01L}{0.02L}$=0.2mol/L,
故答案为:28.6;0.2.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量与物质的量浓度、摩尔质量之间的关系为解答关键,注意掌握稀释过程中溶质的物质的量不变,试题培养了学生的化学计算能力.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
18.室温下,下列各组粒子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1FeCl3溶液中:K+、Na+、AlO2-、SCN- | |
| B. | 能溶解CaCO3的溶液中:Fe2+、Ca2+、Cl-、NO${\;}_{{3}_{\;}^{\;}}^{-}$ | |
| C. | 澄清透明的溶液中:Cu2+、Mg2+、SO${\;}_{4}^{2-}$、Cl- | |
| D. | 由水电离得到的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- |
5.在含有大量的Fe3+、Cl-、SO42-的溶液中还可能大量存在的离子是( )
| A. | Ag+ | B. | H+ | C. | OH- | D. | Ba2+ |
15.下列说法正确的是( )
| A. | 需要加热才发生的化学反应,反应物的总能量可能高于生成物的总能量 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
2.青蒿酸(结构如图)具有致癌抗疟作用,下列有关它的叙述不正确的是( )
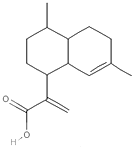

| A. | 能发生酯化反应 | B. | 属于芳香族化合物 | ||
| C. | 能与NaHCO3溶液反应 | D. | 能使溴的四氯化碳溶液褪色 |
20.实验室里需要450mL 0.1mol/L的氢氧化钠溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
| A. | 称取1.8g氢氧化钠固体,加入450mL水 | |
| B. | 称取1.8g氢氧化钠固体配成450mL溶液 | |
| C. | 称取2.0g氢氧化钠固体,加入500mL水 | |
| D. | 称取2.0g氢氧化钠固体配成500mL溶液 |