题目内容
1.有一包白色固体混合物,该混合物可能含有CuSO4、Na2CO3、Na2SO4、MgCl2,现进行如下实验:(1)将混合物溶于水,得到无色透明溶液.
(2)取上述溶液分成两份盛于试管中,其中一份滴加BaCl2溶液,产生白色沉淀,再加稀硝酸,沉淀不溶解;另一份滴加NaOH溶液,有白色沉淀生成.试根据实验现象推断,并完成下面的填空:
该混合物中肯定没有CuSO4和Na2CO3;肯定含有Na2SO4和MgCl2(写化学式).
分析 (1)将混合物溶于水,得到无色透明溶液,故一定不含有CuSO4,且不能含有相互反应生成沉淀的物质,故Na2CO3、MgCl2不能共存;
(2)取上述溶液分成两份盛于试管中,其中一份滴加BaCl2溶液,产生白色沉淀,再加稀硝酸,沉淀不溶解,说明一定含有硫酸根离子,即一定含有Na2SO4,另一份滴加NaOH溶液,有白色沉淀生成,说明一定含有:MgCl2,那么一定不含有:Na2CO3,据此分析解答.
解答 解:(1)将混合物溶于水,得到无色透明溶液,故一定不含有CuSO4,且不能含有相互反应生成沉淀的物质,故Na2CO3、MgCl2不能共存;
(2)取上述溶液分成两份盛于试管中,其中一份滴加BaCl2溶液,产生白色沉淀,再加稀硝酸,沉淀不溶解,说明一定含有硫酸根离子,即含有Na2SO4,另一份滴加NaOH溶液,有白色沉淀生成,说明一定含有:MgCl2,那么一定不含有:Na2CO3,
依据分析可知:该混合物中一定有:Na2SO4、MgCl2,一定没有:CuSO4、Na2CO3;
故答案为:CuSO4;Na2CO3;Na2SO4;MgCl2.
点评 本题主要考查的是几组未知物的检验,抓住溶液的颜色、复分解反应的现象是解决此类题的关键,肯定一种物质的存在,同时排除不共存物质的存在是常利用的解题方法.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
9.将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,此装置称为甲烷燃料电池.下列叙述中正确的是( )
| A. | 通入CH4的电极为正极 | |
| B. | 放电时溶液中的阳离子向负极移动 | |
| C. | 负极的电极反应式为:CH4+10OH--8e-═CO32-+7H2O | |
| D. | 通入CH4的电极反应式为:CH4+2O2+4e-═CO2+2H2O |
10.下列物质与其用途完全符合的有多少条( )
①干冰-人工降雨
②Na2CO3-制玻璃
③Fe2O3-红色油漆或涂料
④Al2O3-耐火材料
⑤NaClO-消毒剂
⑥NaCl-制纯碱;
⑦KAl (SO4 )2-消毒、净水.
①干冰-人工降雨
②Na2CO3-制玻璃
③Fe2O3-红色油漆或涂料
④Al2O3-耐火材料
⑤NaClO-消毒剂
⑥NaCl-制纯碱;
⑦KAl (SO4 )2-消毒、净水.
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
7.下列化学实验能达到目的是( )
| A. | 用饱和NaHCO3溶液除CO2中的氯化氢气体 | |
| B. | SO2与乙烯的混合气体依次通入酸性高锰酸钾溶液、浓硫酸洗气后可得到纯净的SO2 | |
| C. | 用酒精萃取碘水中的碘单质 | |
| D. | 用CaO干燥Cl2 |
13.固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种.某化学兴趣小组为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:
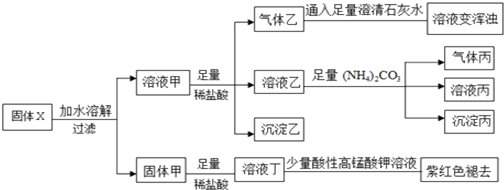
已知:HCO3-+AlO2-+H2O═Al (OH)3↓+CO32-;S2O32-+2H+═S↓+SO2↑+H2O.下列说法正确的是( )

已知:HCO3-+AlO2-+H2O═Al (OH)3↓+CO32-;S2O32-+2H+═S↓+SO2↑+H2O.下列说法正确的是( )
| A. | 气体乙和气体丙都为纯净物 | |
| B. | 固体粉末X中一定含有FeO、Na2S2O3、NaAlO2、Na2CO3,可能含有NaHCO3 | |
| C. | 溶液丁中的阳离子可能只含H+、Fe2+ | |
| D. | 溶液甲中一定含有AlO2-、CO32-、HCO3- |
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | lmol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |