题目内容
17.某原电池工作时总的反应为Zn+Cu2+═Zn2++Cu,该原电池的组成可能是( )| A. | Zn为正极,Cu为负极,CuCl2溶液作电解质溶液 | |
| B. | Cu为正极,Zn为负极,稀H2SO4作电解质溶液 | |
| C. | Cu为正极,Zn为负极,CuSO4溶液作电解质溶液 | |
| D. | Fe为正极,Zn为负极,ZnSO4溶液作电解质溶液 |
分析 根据电池反应式知,失电子的金属作负极,则锌作负极,不如负极活泼的金属或导电的非金属作正极,铜离子得电子发生还原反应,所以电解质溶液中含有铜离子,则电解质溶液为可溶性的铜盐,以此解答该题.
解答 解:根据电池反应式知,锌失电子发生氧化反应而作负极,不如负极活泼的金属或导电的非金属作正极,正极可为Cu、C等,正极上铜离子得电子发生还原反应,则电解质溶液中含有铜离子,所以电解质溶液为可溶性的铜盐,
故选C.
点评 本题考查了原电池工作原理,为高频考点,答题时注意判断正负极、电解质溶液时,要根据电池反应式判断:发生氧化反应的电极为负极,发生还原反应的电极为正极,含有发生还原反应的离子溶液为电解质溶液,难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
8.氢气用于烟气的脱氮、脱硫的反应 4H2(g)+2NO(g)+SO2(g)?N2(g)+S(l)+4H2O(g)△H<0.下列有关说法正确的是( )
| A. | 当v(H2)=v(H2O)时,达到平衡 | |
| B. | 升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动 | |
| C. | 使用高效催化剂可提高NO的平衡转化率 | |
| D. | 化学平衡常数表达式为K=$\frac{c({N}_{2})•{c}^{4}({H}_{2}O)}{c(S{O}_{2})•{c}^{2}(NO)•{c}^{4}({H}_{2})}$ |
2.在一定条件下,Na2CO3溶液中存在如下反应:CO${\;}_{3}^{2-}$+H2O═HCO${\;}_{3}^{-}$+OH-下列说法中正确的是( )
| A. | 溶液中加水,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| B. | 加入Na2CO3固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,溶液pH增大 |
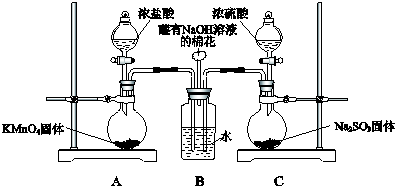
6.某实验兴趣小组按如图装置实验后,所记录内容合理的是( )
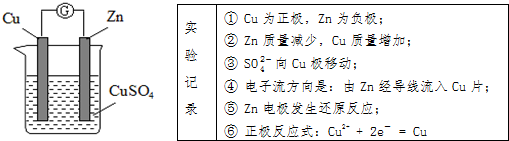

| A. | ②③④ | B. | ①②④⑥ | C. | ①②④⑤ | D. | ②③⑤⑥ |
7.关于Na2CO3和NaHCO3的下列说法中正确的是( )
| A. | 相同条件下NaHCO3比Na2CO3更 稳定 | |
| B. | 向等量的Na2CO3和NaHCO3固体中分别滴加同浓度的盐酸,后者产生气泡速率快 | |
| C. | 相同条件下NaHCO3比Na2CO3更易溶于水 | |
| D. | 经实验测定,Na2CO3溶液显碱性,说明Na2CO3属于碱 |

 某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题.
某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题. 如图所示的装置为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到现象为铁钉附近的溶液有蓝色沉淀,该反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓; 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为O2+4e-+2H2O=4OH.
如图所示的装置为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到现象为铁钉附近的溶液有蓝色沉淀,该反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓; 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为O2+4e-+2H2O=4OH.