题目内容
10.下列有关实验误差分析中,正确的是( )| A. | 用湿润的pH试纸测稀碱液的pH值,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时仰视刻度线,所配溶液浓度偏大 | |
| C. | 用盐酸标准溶液滴定未知浓度的NaOH溶液时,若滴定前滴定管内无气泡,终点读数时有气泡,则所测NaOH溶液的浓度偏大 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏高 |
分析 A.根据湿润的pH值试纸可以稀释碱液;
B.根据定容时仰视刻度线,导致所配溶液的体积偏大,结合c=$\frac{n}{V}$判断;
C.根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
D.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大.
解答 解:A.湿润的pH值试纸可以稀释碱液,溶液中氢氧根离子浓度减小,测定的溶液碱性减弱,pH值偏小,故A正确;
B.定容时仰视刻度线,导致所配溶液的体积偏大,根据c=$\frac{n}{V}$可知,所配溶液的浓度偏小,故B错误;
C.若滴定前滴定管内无气泡,终点读数时有气泡,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故C错误;
D.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大,所测温度值偏小,故D错误;
故选A.
点评 本题考查实验基本操作、误差分析等,难度中等,理解实验进行的原理是解题的关键,注实验基本操作的掌握.

练习册系列答案
相关题目
1.(1)已知在常温常压下:
①2CH3OH(I)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(I)△H=-44.0kJ/mol
请写出1mol甲醇不完全燃烧生成1mol一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图1装置模拟上述过程:

①写出阳极电极反应式Co2+-e-=Co3+;
②除去甲醇的离子反应为:6Co3++CH3OH+H2O═CO2↑+6Co2++6H+.该过程中被氧化的元素是碳,当产生标准状况下2.24LCO2时,共转移电子0.6mol.
(3)测定稀硫酸和稀氢氧化钠中和热的实验装置如图2所示.0.50mol/LNaOH溶液50mL和0.50mol/L硫酸溶液30mL进行实验,实验数据如表所示.
①请写下表中的空白.
②近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃),则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验数值与57.3kJ/mol有偏差,产生偏差的原因可能是acd.
a.实验装置保湿或隔热效果差 b.用量筒量取NaOH溶液的体积时俯视读数
c.用环形铜丝搅拌棒搅拌溶液 d用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
①2CH3OH(I)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(I)△H=-44.0kJ/mol
请写出1mol甲醇不完全燃烧生成1mol一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图1装置模拟上述过程:

①写出阳极电极反应式Co2+-e-=Co3+;
②除去甲醇的离子反应为:6Co3++CH3OH+H2O═CO2↑+6Co2++6H+.该过程中被氧化的元素是碳,当产生标准状况下2.24LCO2时,共转移电子0.6mol.
(3)测定稀硫酸和稀氢氧化钠中和热的实验装置如图2所示.0.50mol/LNaOH溶液50mL和0.50mol/L硫酸溶液30mL进行实验,实验数据如表所示.
①请写下表中的空白.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t℃/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值与57.3kJ/mol有偏差,产生偏差的原因可能是acd.
a.实验装置保湿或隔热效果差 b.用量筒量取NaOH溶液的体积时俯视读数
c.用环形铜丝搅拌棒搅拌溶液 d用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
2.某科研小组探究工业废Cu粉(杂质可能含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4•5H2O,实现废物综合利用.他们进行了两组实验,过程如下:
Ⅰ: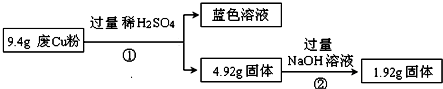
Ⅱ:
(1)废Cu粉中含有的杂质是SiO2、Fe2O3.
(2)分别写出过程①③中发生反应的离子方程式:
①Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、Cu+2Fe3+═2Fe2++Cu2+;③SiO2+2OH-═SiO32-+H2O、Al2O3+2OH-=2AlO2-+H2O.
(3)综合过程Ⅰ、II,计算工业废Cu粉中各成分的质量之比是m(Fe2O3):m(Cu):m(SiO2)=16:16:15(可不必化简).(4)已知25℃时:
从Ⅱ中所得蓝色溶液中分离提纯得到CuSO4•5H2O晶体,需要经过下列步骤:
a、向蓝色溶液中加入一定量的H2O2 溶液;
b、调节溶液的pH为4.0≤pH<5.4之间;
c、然后过滤、结晶,再过滤,可得CuSO4•5H2O.
下列关于实验操作的叙述中,正确的是ACD(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.上述步骤c中第一次过滤是为了得到滤液,第二次过滤是为了得到固体
D.在pH>4的溶液中Fe3+一定不能大量存在.
Ⅰ:

Ⅱ:

(1)废Cu粉中含有的杂质是SiO2、Fe2O3.
(2)分别写出过程①③中发生反应的离子方程式:
①Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、Cu+2Fe3+═2Fe2++Cu2+;③SiO2+2OH-═SiO32-+H2O、Al2O3+2OH-=2AlO2-+H2O.
(3)综合过程Ⅰ、II,计算工业废Cu粉中各成分的质量之比是m(Fe2O3):m(Cu):m(SiO2)=16:16:15(可不必化简).(4)已知25℃时:
| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
a、向蓝色溶液中加入一定量的H2O2 溶液;
b、调节溶液的pH为4.0≤pH<5.4之间;
c、然后过滤、结晶,再过滤,可得CuSO4•5H2O.
下列关于实验操作的叙述中,正确的是ACD(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.上述步骤c中第一次过滤是为了得到滤液,第二次过滤是为了得到固体
D.在pH>4的溶液中Fe3+一定不能大量存在.
19.下列对能量转化的认知中,不正确的是( )
| A. | 白炽灯工作时,电能全部转化为光能 | |
| B. | 风力发电时,风能主要转化为电能 | |
| C. | 煤燃烧时,化学能主要转化热能 | |
| D. | 电解水生成H2和O2时,电能主要转化为化学能 |
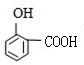 .
.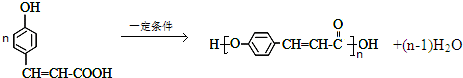 .
. .
.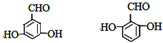 .
.