题目内容
17.一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )| A. | 若增大压强,则物质Y的转化率减小 | |
| B. | 将容器体积变为5 L,Z的平衡浓度变为原来的2倍 | |
| C. | Y浓度变化表示的反应速率为0.0005 mol/(L•s ) | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
分析 经60s达到平衡,生成0.3mol Z,则
2X(g)+Y(g)?Z(g)
开始 1 1 0
转化 0.6 0.3 0.3
平衡 0.4 0.7 0.7
A.该反应为气体体积减小的反应,增大压强平衡正向移动;
B.体积减小一半,若平衡不移动,Z的浓度为原来的2倍,但增大压强平衡正向移动;
C.结合v=$\frac{△c}{△t}$计算;
D.若升高温度,X的体积分数增大,可知升高温度,平衡逆向移动.
解答 解:A.该反应为气体体积减小的反应,增大压强平衡正向移动,则物质Y的转化率增大,故A错误;
B.体积减小一半,若平衡不移动,Z的浓度为原来的2倍,但增大压强平衡正向移动,则Z的平衡浓度变大于原来的2倍,故B错误;
C.Y浓度变化表示的反应速率为$\frac{\frac{0.3mol}{10L}}{60s}$=0.0005 mol/(L•s ),故C正确;
D.若升高温度,X的体积分数增大,可知升高温度,平衡逆向移动,则该反应的△H<0,故D错误;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、速率计算、平衡移动为解答的关键,侧重分析与计算能力的考查,注意平衡移动原理的应用,题目难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
7.在2NO2?N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
| A. | N2O4和NO2的分子数比为1:2 | |
| B. | N2O4和NO2的浓度相等 | |
| C. | 体系的颜色不再改变 | |
| D. | 单位时间内有1molN2O4转化为NO2的同时,有2molNO2转化为N2O4 |
8.同温同压下,四个等体积的干燥圆底烧瓶中分别充满:①NH3 ②HCl(混有少量空气),③NO2,④NO2和O2(4:1)的混合气体,进行喷泉实验,经充分反应后,圆底瓶内溶液的物质的量浓度为(设溶质不扩散)( )
| A. | ①>②>③>④ | B. | ①=②=③=④ | C. | ①=②=③>④ | D. | ①>②>③=④ |
5.如图,将锌片和铜片用导线连接后放入稀硫酸中,下列有关说法中正确的是( )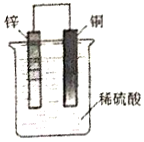

| A. | 铜片为电池的负极 | |
| B. | SO42-向负极移动 | |
| C. | 电子从铜片流向锌片 | |
| D. | 铜片上发生的电极反应为Cu-2e-═Cu2+ |
12.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | CO2H2S | B. | NH3 HCl | C. | P4 CCl4 | D. | C2H4 CH4 |
2.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知反应Fe2O3+3Na2O2$\frac{\underline{\;熔融\;}}{\;}$2Na2FeO4+Na2O,下列说法不正确的是( )
| A. | 该反应中Na2O2既是氧化剂又是还原剂 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 1mol Na2O2发生反应,有2mol电子转移 | |
| D. | 在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌 |
9.下列关于原子结构与元素性质的说法正确的是( )
| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 全部由非金属元素组成的化合物中只含共价键 | |
| C. | ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 |
6. 短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为黄色固体,易溶在XZ2中,p是一种二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为黄色固体,易溶在XZ2中,p是一种二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
 短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为黄色固体,易溶在XZ2中,p是一种二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为黄色固体,易溶在XZ2中,p是一种二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )| A. | 原子半径:W<X<Y | |
| B. | W与X组成的化合物中可能含有极性键和非极性键 | |
| C. | Y与Z组成的化合物一定有漂白性 | |
| D. | W与X、Y、Z组成的简单化合物的稳定性:X>Y>Z |