题目内容
19.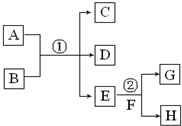 在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:(1)写出反应②的化学反应方程式2Na2O2+2H2O=4NaOH+O2↑,在该反应中,每生成2.24LG(标准状况),该反应转移电子的物质的量是0.2mol.
(2)若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C和D之间.则反应①的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O.
(3)若反应①在溶液中进行,A是一种强酸,B是一种含两种金属元素的盐,当A过量时,C及D均易溶于水.则A过量时反应①的离子反应方程式是AlO2-+4H+=Al3++2H2O.
分析 (1)E常温下为无色无味的液体,F为淡黄色粉末,G为常见无色气体,E与F反应生成G,则E为H2O,F为Na2O2,G为O2,H为NaOH;
(2)若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,Cl2和NaOH的反应生成NaCl和NaClO符合转化关系;
(3)若反应①在溶液中进行,A是一种强酸,B是一种含两种金属元素的盐,当A过量时,C及D均易溶于水,偏铝酸钠与盐酸反应符合转化关系.
解答 解:(1)E常温下为无色无味的液体,F为淡黄色粉末,G为常见无色气体,E与F反应生成G,则E为H2O,F为Na2O2,G为O2,H为NaOH,反应②的化学反应方程式:2Na2O2+2H2O=4NaOH+O2↑,在该反应中,生成氧气为$\frac{2.24L}{22.4L/mol}$=0.1mol,反应转移电子的物质的量是0.1mol×2=0.2mol,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;0.2mol;
(2)若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,Cl2和NaOH的反应生成NaCl和NaClO符合转化关系,则反应①的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(3)若反应①在溶液中进行,A是一种强酸,B是一种含两种金属元素的盐,当A过量时,C及D均易溶于水,偏铝酸钠与盐酸反应符合转化关系,则A过量时反应①的离子反应方程式是AlO2-+4H+=Al3++2H2O,
故答案为:AlO2-+4H+=Al3++2H2O.
点评 本题考查无机物推断,属于开放性题目,需要学生熟练掌握元素化合物性质,注意(2)(3)答案不唯一性,难度中等.

 阅读快车系列答案
阅读快车系列答案①取少量E,加入稀硝酸直至过量,白色沉淀部分溶解;
②取少量G,逐滴加入稀硫酸直至过量,开始时不断生成白色沉淀后沉淀部分溶解;
③取少量G,滴加少量酸性高锰酸钾溶液,振荡,最终得无色溶液.
根据上述实验现象,以下推测不正确的是( )
| A. | 固体中无FeCl2 | B. | ③中使KMnO4褪色的是NO2- | ||
| C. | G的pH>7 | D. | 固体由Ba(OH)2?AlCl3?Na2SO3组成 |
| A. | 纳米铜是一种新型单质 | |
| B. | 纳米铜颗粒比普通铜更难与氧气发生反应 | |
| C. | 纳米铜与普通铜所含铜原子的种类相同 | |
| D. | 纳米铜无需密封保存 |
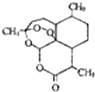 青蒿素是一种高效、速率搞疟药,是中医献给世界的一份礼物.其结构简式如图所示.下列有关青蒿素的说法正确的是( )
青蒿素是一种高效、速率搞疟药,是中医献给世界的一份礼物.其结构简式如图所示.下列有关青蒿素的说法正确的是( )| A. | 易溶于乙醚等有机溶剂 | B. | 分子式为C15H21O5 | ||
| C. | 能在热的NaOH溶液中存在 | D. | 分子结构中含有极性键 |
| A. | 1:2 | B. | 2:3 | C. | 8:9 | D. | 1:1 |
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、蒸馏
③除去C2H6中少量的C2H4:气体通过盛有酸性高锰酸钾溶液的洗气瓶
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
| A. | 分别将它们配制成溶液,再加入澄清石灰水 | |
| B. | 分别将它们配制成溶液,再逐滴加入等浓度的稀盐酸 | |
| C. | 分别将它们配制成溶液,再加入CaCl2溶液 | |
| D. | 分别加热,再用石灰水检验是否有CO2产生 |