题目内容
6.类推的思维方法在化学学习中应用广泛,以下类推结论正确的是( )| A. | 钠在实验室通常保存在煤油中,可推知锂也可保存在煤油中 | |
| B. | FeCl2与Cl2反应生成FeCl3,可推知FeBr2也可与Br2反应生成FeBr3 | |
| C. | 工业制Mg采用电解MgCl2的方法,可推知工业制Al也采用电解AlCl3的方法 | |
| D. | CO2通入Ba(NO3)2溶液中无明显现象,可推知SO2通入Ba(NO3)2溶液中也无明显现象 |
分析 A.依据煤油的密度小于钠,大于锂解答;
B.氯气、溴氧化性强于三价铁离子;
C.氯化镁为离子化合物,氯化铝共价化合物;
D.二氧化硫能够被硝酸根离子氧化生成硫酸根离子.
解答 解:A.煤油的密度小于钠,大于锂,钠放在煤油中能够沉在底部,起到隔绝空气作用,而锂密度小于煤油,浮在煤油上,不能隔绝空气,故A错误;
B.氯气、溴氧化性强于三价铁离子,氯气、溴都能够氧化二价铁离子生成三价铁离子,故B正确;
C.氯化铝是共价化合物,熔融状态下不导电,所以不能用电解质熔融氯化铝方法制取铝,故C错误;
D.二氧化硫能够被硝酸根离子氧化生成硫酸根离子,所以二氧化硫通入Ba(NO3)2溶液中,生成白色的硫酸钡沉淀,故D错误;
故选:B.
点评 本题考查了元素化合物知识,明确相关物质的性质及电解池工作原理是解题关键,题目难度不大.

练习册系列答案
相关题目
9.烃A的结构简式为(CH3)2CHCH2CH2CH2CH3;已知A是由烯烃B跟H2在一定条件下加成制得,则B的结构最多有( )
| A. | 6种 | B. | 4种 | C. | 5种 | D. | 3种 |
17.在含有0.6molCl-、0.8molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响).若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x.则下列正确的是( )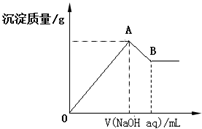

| A. | x=$\frac{3a}{5-a}$ | |
| B. | x的取值范围是0<x<$\frac{11}{32}$ | |
| C. | A点横坐标的值不随x发生变化 | |
| D. | 若B点横坐标为200mL时,c(NaOH)=7.0mol/L |
11.一份由氧化镁、氧化铝、二氧化硅和氧化铁组成的混合物粉末,先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y.下列叙述正确的是( )
| A. | 该混合粉末从组成看,其成分皆是碱性氧化物 | |
| B. | 溶液Y 中2n(Mg2+)<n(Cl-)<3n(Fe3+) | |
| C. | 沉淀X的成分为二氧化硅 | |
| D. | 在溶液Y 中加入过量的氨水,过滤得到的沉淀的成分是氢氧化铁和氢氧化镁 |
18.下列物质的溶液经加热、蒸发、浓缩、结晶、灼烧后,所得固体的成分不相同的是( )
| A. | FeCl2、FeCl3 | B. | NaHCO3、Na2CO3 | C. | NaAlO2、AlCl3 | D. | Mg(HCO3)2、MgCl2 |
16.为了测定铁铜合金的组成,将7.6g铁、铜合金加入100mL某浓度的稀硝酸中,待合金完全溶解后,共收集到NO气体2.24L(标准状况下),并测得溶液中H+的浓度为0.5mol•L-1.若反应前后溶液的体积变化忽略不计,则下列判断正确的是( )
| A. | 上述反应中金属共失去电子0.1 mol | |
| B. | 合金中,铜的质量为2.8 g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5 mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5 mol•L-1的NaOH溶液60 mL |
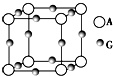 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.