题目内容
下列叙述一定正确的是( )
| A、H2O、D2O、T2O互为同位素 |
| B、pH=1的溶液中,K+、Na+、NO3-、S2O32-不能大量共存 |
| C、元素周期表中从上至下同主族元素的氢化物的熔、沸点依次升高 |
| D、乙炔、氢气、铁分别与氯气反应,都会因用量或条件不同而生成不同产物 |
考点:同一主族内元素性质递变规律与原子结构的关系,同位素及其应用,离子共存问题,氯气的化学性质
专题:
分析:A.具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素;
B.S2O32-与H+反应生成二氧化硫和硫单质;
C.含有氢键的熔沸点较高;
D.氢气、铁分别与氯气反应生成只有一种产物.
B.S2O32-与H+反应生成二氧化硫和硫单质;
C.含有氢键的熔沸点较高;
D.氢气、铁分别与氯气反应生成只有一种产物.
解答:
解:A.具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素,H2O、D2O、T2O属于化合物,不是同位素,故A错误;
B.S2O32-与H+反应生成二氧化硫和硫单质,所以pH=1的溶液中,K+、Na+、NO3-、S2O32-不能大量共存,故B正确;
C.含有氢键的熔沸点较高,如第VIIA族元素的氢化物的熔沸点:HF>HI>HBr>HCl,故C错误;
D.乙炔与氯气反应可以生成二氯乙烯或四氯乙烷,氢气、铁分别与氯气反应生成只有一种产物,故D错误.
故选B.
B.S2O32-与H+反应生成二氧化硫和硫单质,所以pH=1的溶液中,K+、Na+、NO3-、S2O32-不能大量共存,故B正确;
C.含有氢键的熔沸点较高,如第VIIA族元素的氢化物的熔沸点:HF>HI>HBr>HCl,故C错误;
D.乙炔与氯气反应可以生成二氯乙烯或四氯乙烷,氢气、铁分别与氯气反应生成只有一种产物,故D错误.
故选B.
点评:本题考查了同位素的概念、离子共存、氢键、物质的性质等,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
下列说法正确的是( )
| A、强电解质溶液导电能力一定比弱电解质溶液导电能力强 |
| B、水的电离过程是吸热过程,升高温度,KW和pH都增大 |
| C、AlCl3和FeCl3既可作净水剂也可作消毒剂 |
| D、将碳酸钠溶液蒸干并灼烧,所得固体的成分仍为碳酸钠 |
T℃时A气体与B气体反应生成C气体.反应过程中A、B、C浓度(mol/L)随时间变化如图I所示;若保持其他条件不变,温度分别为T1和T2时,C的体积分数与时间的关系如图Ⅱ所示.下列结论正确的是( )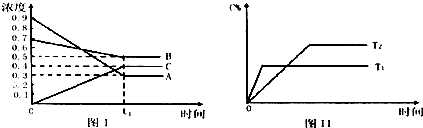

| A、在时间为t1时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
| B、在时间为t1时,保持温度和压强不变,通入稀有气体,平衡向正反应方向移动 |
| C、其它条件不变,T℃时由0.6 mol/LA、0.6mol/LB、0.2mol/LC开始反应,达到平衡后C的浓度仍为0.4mol/L |
| D、其它条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
下列有关说法正确的是( )
| A、所有氧化还原反应中,氧化剂的氧化性一定强于氧化产物的氧化性 |
| B、根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 |
| C、用酿造C2H5OH作燃料,不会增加大气中CO2含量 |
| D、氟氯烃含量是空气质量报告的主要项目之一 |
有关下列说法正确的是( )
| A、6.8g熔融KHSO4与3.9g Na202阴离子数目相同 |
B、某金属阳离子的结构为: 与Cl-形成的强电解质都是离子化合物 与Cl-形成的强电解质都是离子化合物 |
C、二硫化碳是直线型的分子,其电子式是: |
| D、因为氯、溴、碘非金属性逐渐减弱,所以其氢化物酸性HCl>HBr>HI |
NA为阿伏加德罗常数,下列叙述中正确的有( )
| A、1molFeCl3完全转化成氢氧化铁胶体后生成 NA个胶粒 |
| B、1molH2O2与MnO2充分作用后,转移2NA个电子 |
| C、标准状况下,22.4升H2与4克氦气均含NA个分子 |
| D、50℃,1×105Pa下46克NO2与0℃,2×105Pa下46克N2O4均含有3NA个原子 |
 .如图所示是九种化合物的转变关系.
.如图所示是九种化合物的转变关系.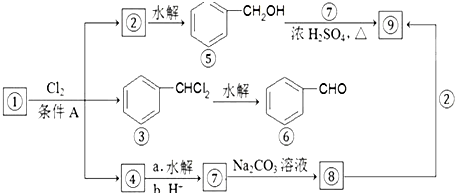
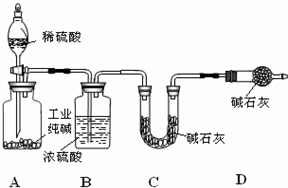 工业纯碱中常含有NaCl、Na2SO4杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:
工业纯碱中常含有NaCl、Na2SO4杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置: