题目内容
下列说法正确的是( )
| A、强电解质溶液导电能力一定比弱电解质溶液导电能力强 |
| B、水的电离过程是吸热过程,升高温度,KW和pH都增大 |
| C、AlCl3和FeCl3既可作净水剂也可作消毒剂 |
| D、将碳酸钠溶液蒸干并灼烧,所得固体的成分仍为碳酸钠 |
考点:盐类水解的应用,水的电离
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A、电解质溶液导电能量的强弱决定于离子浓度的大小,与电解质强弱无关;
B、水电离吸热,升温促进水的电离;
C、AlCl3和FeCl3溶液可以净水,无消毒作用;
D、将碳酸钠溶液蒸干并灼烧,所得固体为碳酸钠.
B、水电离吸热,升温促进水的电离;
C、AlCl3和FeCl3溶液可以净水,无消毒作用;
D、将碳酸钠溶液蒸干并灼烧,所得固体为碳酸钠.
解答:
解:A、离子浓度较大的弱电解质溶液的导电能力比离子浓度较小的强电解质溶液强,故A错误;
B、升温水的pH减小,故B错误;
C、AlCl3和FeCl3溶液可以净水,无消毒作用,故C错误;
D、碳酸钠水解产生的NaOH无挥发性,所以将碳酸钠溶液蒸干并灼烧,所得固体为碳酸钠,故D正确;
故选D.
B、升温水的pH减小,故B错误;
C、AlCl3和FeCl3溶液可以净水,无消毒作用,故C错误;
D、碳酸钠水解产生的NaOH无挥发性,所以将碳酸钠溶液蒸干并灼烧,所得固体为碳酸钠,故D正确;
故选D.
点评:本题考查了溶液导电能力强弱的原因、水的电离、水的消毒、盐类水解的应用,题目难度中等.

练习册系列答案
相关题目
某有机化合物结构简式如图所示,关于该化合物的下列说法中不正确的是( )

| A、该化合物能发生消去反应 |
| B、1mol该化合物与NaOH溶液完全反应,最多可消耗6moINaOH |
| C、该化合物能和溴的CCl4溶液发生加成反应 |
| D、该化合物在稀硫酸存在下水解所得产物之一可发生消去反应 |
下列说法正确的是( )
| A、强电解质和弱电解质的本质区别在于电离程度的不同 |
| B、中性溶液中既没有H+也没有OH- |
| C、pH=4的溶液稀释10000倍,会成为碱性溶液 |
| D、向缓冲溶液中加入少量的酸或碱时,溶液的pH基本不发生变化 |
HPE是合成除草剂的重要中间体,其结构简式如图所示:下列有关HPE的说法正确的是( )
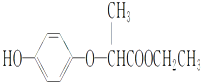

| A、1 mol HPE最多可以和2 mol NaOH反应 |
| B、HPE不能跟浓溴水反应 |
| C、HPE在1H核磁共振谱中有8种峰 |
| D、该物质不能发生在加成反应 |
 已知分子式为C12H12的物质A结构简式为如图:已知A的环上的二溴代物有9种同分异构物,由此推断A的环上的四溴代物的异构体的数目有( )
已知分子式为C12H12的物质A结构简式为如图:已知A的环上的二溴代物有9种同分异构物,由此推断A的环上的四溴代物的异构体的数目有( )| A、9种 | B、10种 |
| C、11种 | D、2种 |
将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体粉末.下列有关叙述不正确的是( )
| A、表面迅速变暗是因为生成了氧化钠 |
| B、“出汗”是因为表面形成了NaOH溶液 |
| C、白色固体粉末是碳酸钠 |
| D、以上三个过程均发生了氧化还原反应 |
下列叙述一定正确的是( )
| A、H2O、D2O、T2O互为同位素 |
| B、pH=1的溶液中,K+、Na+、NO3-、S2O32-不能大量共存 |
| C、元素周期表中从上至下同主族元素的氢化物的熔、沸点依次升高 |
| D、乙炔、氢气、铁分别与氯气反应,都会因用量或条件不同而生成不同产物 |