题目内容
 工业纯碱中常含有NaCl、Na2SO4杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:
工业纯碱中常含有NaCl、Na2SO4杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:(碱石灰是一种碱性干燥剂,是CaO固体和NaOH固体的混合物,能吸收水和酸性气体)
试回答下列问题:
(1)装置A中发生反应的化学方程式
(2)装置D的作用是
(3)实验前称取工业纯碱的质量为m g,装置C中碱石灰和U型管的总质量为m1 g.加入足量稀硫酸,反应结束后,装置C中碱石灰和U型管的总质量变为m2 g.则上述实验中测得的工业纯碱中的Na2CO3质量分数为
(4)若没有装置D,测定结果将会
(5)利用上图A、B装置(B中仍用硫酸作干燥剂),再加一个集气装置,除CO2外还可以制取哪种气体?
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:实验实验原理是:纯碱和稀硫酸反应生成二氧化碳气体,经浓硫酸干燥后被碱石灰吸收,根据二氧化碳的质量可确定纯碱的含量,但本题实验存在缺陷,即装置内残留的二氧化碳不能被完全吸收,C连接D可防止空气中水、二氧化碳进入C中,导致实验结果偏大,以此解答该题.
解答:
解:(1)纯碱和稀硫酸反应生成二氧化碳气体,发生反应为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,故答案为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(2)C连接D可防止空气中水、二氧化碳进入C中,导致实验结果偏大,干扰碳酸钠含量的测定,
故答案为:防止空气中的CO2、H2O进入U形管,干扰碳酸钠含量的测定;
(3)装置C中碱石灰吸收的为二氧化碳,m(CO2)=(m2-m1)g,n(Na2CO3)=n(CO2)=
mol,m(Na2CO3)=
g,所以工业纯碱中Na2CO3的质量分数为
×100%,
故答案为:
×100%;
(4)装置D没有,空气中的二氧化碳和水蒸气会进入装置C,使测定二氧化碳质量增大,结果偏高;装置A、B中残留的二氧化碳不能被完全吸收,应通入氮气将二氧化碳赶出,否则会导致含量偏小,
故答案为:偏大;偏小;
(5)利用上图A、B装置(B中仍用硫酸作干燥剂),再加一个集气装置,除CO2外还可以制取的气体可以是氧气,利用过氧化氢滴入固体二氧化锰中生成,
故答案为:O2.
(2)C连接D可防止空气中水、二氧化碳进入C中,导致实验结果偏大,干扰碳酸钠含量的测定,
故答案为:防止空气中的CO2、H2O进入U形管,干扰碳酸钠含量的测定;
(3)装置C中碱石灰吸收的为二氧化碳,m(CO2)=(m2-m1)g,n(Na2CO3)=n(CO2)=
| m2-m1 |
| 44 |
| 106(m2-m1) |
| 44 |
| 106(m2-m1) |
| 44m |
故答案为:
| 106(m2-m1) |
| 44m |
(4)装置D没有,空气中的二氧化碳和水蒸气会进入装置C,使测定二氧化碳质量增大,结果偏高;装置A、B中残留的二氧化碳不能被完全吸收,应通入氮气将二氧化碳赶出,否则会导致含量偏小,
故答案为:偏大;偏小;
(5)利用上图A、B装置(B中仍用硫酸作干燥剂),再加一个集气装置,除CO2外还可以制取的气体可以是氧气,利用过氧化氢滴入固体二氧化锰中生成,
故答案为:O2.
点评:本题考查物质的含量的测定的实验设计,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验的原理和操作方法,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列叙述一定正确的是( )
| A、H2O、D2O、T2O互为同位素 |
| B、pH=1的溶液中,K+、Na+、NO3-、S2O32-不能大量共存 |
| C、元素周期表中从上至下同主族元素的氢化物的熔、沸点依次升高 |
| D、乙炔、氢气、铁分别与氯气反应,都会因用量或条件不同而生成不同产物 |
烃分子中若含有双键,叁键或环,其碳原子所结合的氢原子则少于同碳原子数对应烷烃所含的氢原子数,亦具有一定的不饱和度(用Ω表示),下表列出几种烃的不饱和度:据此下列说法不正确的是:( )
| 有机物 | 乙烯 | 乙炔 | 环已烷 | 苯 |
| Ω | 1 | 2 | 1 | 4 |
| A、1molΩ=3的不饱和链烃再结合6molH2即达到饱和 |
| B、C10H8的Ω=7 |
| C、C4H8的不饱和度与C3H6、C2H4的不饱和度不相同 |
| D、CH3CH2CH=CH2与环丁烷的不饱和度相同 |
稀土是工业味精,邓小平说过“中东有石油,我们有稀土”.稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应.已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+.下列说法正确的是( )
| A、已知Ce原子序数是58,则其为镧系元素 | ||||||||
B、铈有四种稳定的核
| ||||||||
| C、用Ce(SO4)2溶液可与硫酸亚铁溶液反应,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ | ||||||||
| D、铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、Na2CO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B、25℃,pH=7的NH3?H2O和NH4Cl的混合溶液中:c(Cl-)=c(NH4+)>c(H+)=c(OH-) |
| C、CH3COONa溶液中:c(Na+)>c(CH3COO -)>c(H+)>c(OH-) |
| D、NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(CO32-)+c(HCO3-) |

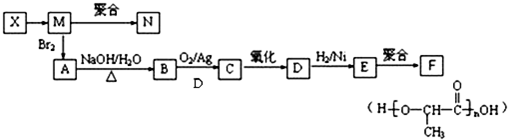
 水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下: