题目内容
T℃时A气体与B气体反应生成C气体.反应过程中A、B、C浓度(mol/L)随时间变化如图I所示;若保持其他条件不变,温度分别为T1和T2时,C的体积分数与时间的关系如图Ⅱ所示.下列结论正确的是( )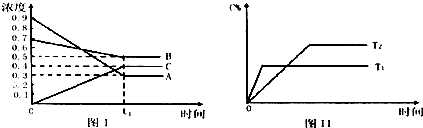

| A、在时间为t1时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
| B、在时间为t1时,保持温度和压强不变,通入稀有气体,平衡向正反应方向移动 |
| C、其它条件不变,T℃时由0.6 mol/LA、0.6mol/LB、0.2mol/LC开始反应,达到平衡后C的浓度仍为0.4mol/L |
| D、其它条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:该反应达到平衡状态时,A浓度的变化量=(0.9-0.3)mol/L=0.6mol/L,B浓度的变化量=(0.7-0.5)mol/L=0.2mol/L,C浓度的变化量=(0.4-0)mol/L=0.4mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:3A(g)+B(g)?2C(g),
根据“先拐先平数值大”结合图II知,T1>T2,升高温度,C的体积发生减小,则该反应的正反应是放热反应;
A.增大压强,平衡向气体体积减小的方向移动;
B.恒压,通入稀有气体,体积增大,压强减小,平衡向气体体积增大的方向移动;
C.先根据图Ⅰ计算平衡常数,再根据平衡常数计算改变三种物质的浓度达到平衡状态时C的浓度;
D.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动.
根据“先拐先平数值大”结合图II知,T1>T2,升高温度,C的体积发生减小,则该反应的正反应是放热反应;
A.增大压强,平衡向气体体积减小的方向移动;
B.恒压,通入稀有气体,体积增大,压强减小,平衡向气体体积增大的方向移动;
C.先根据图Ⅰ计算平衡常数,再根据平衡常数计算改变三种物质的浓度达到平衡状态时C的浓度;
D.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动.
解答:
解:该反应达到平衡状态时,A浓度的变化量=(0.9-0.3)mol/L=0.6mol/L,B浓度的变化量=(0.7-0.5)mol/L=0.2mol/L,C浓度的变化量=(0.4-0)mol/L=0.4mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:3A(g)+B(g)?2C(g),
根据“先拐先平数值大”结合图II知,T1>T2,升高温度,C的体积发生减小,则该反应的正反应是放热反应;
A.该反应的正反应是气体体积减小的反应,t1时,保持其它条件和物质状态不变,增加压强,化学平衡向正反应方向移动,故A错误;
B.该反应的正反应是气体体积减小的反应,恒压,通入稀有气体,体积增大,压强减小,平衡逆向移动,故B错误;
C.根据图Ⅰ知,化学平衡常数K=
=
,
假设C的平衡浓度是0.4mol/L,
3A(g)+B(g)?2C(g)
开始(mol/L)0.6 0.6 0.2
反应(mol/L)0.3 0.1 0.2
平衡(mol/L)0.3 0.5 0.4
化学平衡常数K′=
=
,与平衡常数K相等,故C正确;
D.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,根据图Ⅱ知,正反应是放热反应,所以平衡向逆反应方向移动,A的转化率降低,故D错误;
故选:C.
根据“先拐先平数值大”结合图II知,T1>T2,升高温度,C的体积发生减小,则该反应的正反应是放热反应;
A.该反应的正反应是气体体积减小的反应,t1时,保持其它条件和物质状态不变,增加压强,化学平衡向正反应方向移动,故A错误;
B.该反应的正反应是气体体积减小的反应,恒压,通入稀有气体,体积增大,压强减小,平衡逆向移动,故B错误;
C.根据图Ⅰ知,化学平衡常数K=
| (0.4)2 |
| (0.3)3?(0.5) |
| 80 |
| 27 |
假设C的平衡浓度是0.4mol/L,
3A(g)+B(g)?2C(g)
开始(mol/L)0.6 0.6 0.2
反应(mol/L)0.3 0.1 0.2
平衡(mol/L)0.3 0.5 0.4
化学平衡常数K′=
| (0.4)2 |
| (0.3)3?(0.5) |
| 80 |
| 27 |
D.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,根据图Ⅱ知,正反应是放热反应,所以平衡向逆反应方向移动,A的转化率降低,故D错误;
故选:C.
点评:本题考查外界条件对化学平衡移动的影响及平衡常数的相关计算,正确确定反应方程式是解本题的关键,会根据“先拐先平数值大”确定该反应是吸热反应还是放热反应,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、强电解质和弱电解质的本质区别在于电离程度的不同 |
| B、中性溶液中既没有H+也没有OH- |
| C、pH=4的溶液稀释10000倍,会成为碱性溶液 |
| D、向缓冲溶液中加入少量的酸或碱时,溶液的pH基本不发生变化 |
将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体粉末.下列有关叙述不正确的是( )
| A、表面迅速变暗是因为生成了氧化钠 |
| B、“出汗”是因为表面形成了NaOH溶液 |
| C、白色固体粉末是碳酸钠 |
| D、以上三个过程均发生了氧化还原反应 |
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
| A、溶液中Ca2+数目减少 |
| B、溶液中c(Ca2+)增大 |
| C、溶液中c(Ca2+)减小 |
| D、溶液pH值增大 |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为a HClO3=bO2↑+c Cl2↑+d HClO4+e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色.下列说法正确的是( )
| A、由反应可确定:氧化性HClO4>HClO |
| B、变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5C12+I2+6H2O=12H++10Cl-+2IO3- |
| C、若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示:26HClO3=15O2↑+8C12↑+10HClO4+8H2O |
| D、若化学计量数a=8,b=3,则该反应转移电子数为10e- |
根据原电池形成的条件分析图所示的各装置,其中有电流通过的是( )
A、 乙醇 |
B、 稀硫酸 |
C、 |
D、 稀硫酸 |
下列叙述一定正确的是( )
| A、H2O、D2O、T2O互为同位素 |
| B、pH=1的溶液中,K+、Na+、NO3-、S2O32-不能大量共存 |
| C、元素周期表中从上至下同主族元素的氢化物的熔、沸点依次升高 |
| D、乙炔、氢气、铁分别与氯气反应,都会因用量或条件不同而生成不同产物 |