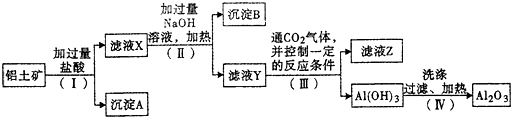
题目内容
利用下列实验装置进行的相应实验,不能达到实验目的是( )


| A、图1所示装置可制取乙炔 |
| B、图2所示装置可分离乙酸乙酯和醋酸钠的水溶液 |
| C、图3所示装置可制取乙烯并验证其易被氧化 |
| D、图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
考点:化学实验方案的评价,乙烯的实验室制法,乙炔炔烃,浓硫酸的性质实验
专题:实验评价题
分析:A.实验室可用饱和食盐水制备乙炔;
B.乙酸乙酯不溶于水;
C.缺少温度计,不能控制反应;
D.浓硫酸可使蔗糖变黑,碳与浓硫酸发生氧化还原反应.
B.乙酸乙酯不溶于水;
C.缺少温度计,不能控制反应;
D.浓硫酸可使蔗糖变黑,碳与浓硫酸发生氧化还原反应.
解答:
解:A.实验室可用饱和食盐水制备乙炔,故A正确;
B.乙酸乙酯不溶于水,可用分液法分离,故B正确;
C.反应在浓硫酸作用下加热,应控制温度在170℃,但缺少温度计,不能确定是否生成乙烯,故C错误;
D.浓硫酸使蔗糖变黑,体现脱水性,与C反应生成二氧化硫,体现其强氧化性,图中品红褪色,说明二氧化硫具有漂白性,高锰酸钾溶液褪色,发生氧化还原反应,说明二氧化硫具有还原性,所以图中装置能说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性,故D正确;
故选C.
B.乙酸乙酯不溶于水,可用分液法分离,故B正确;
C.反应在浓硫酸作用下加热,应控制温度在170℃,但缺少温度计,不能确定是否生成乙烯,故C错误;
D.浓硫酸使蔗糖变黑,体现脱水性,与C反应生成二氧化硫,体现其强氧化性,图中品红褪色,说明二氧化硫具有漂白性,高锰酸钾溶液褪色,发生氧化还原反应,说明二氧化硫具有还原性,所以图中装置能说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性,故D正确;
故选C.
点评:本题考查化学实验方案的评价,涉及气体的制取、混合物的分离、气体的检验、物质的性质,侧重实验装置与物质的性质的考查,题目难度中等.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
下列关于电解质溶液的叙述正确的是( )
| A、常温下,由0.1mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH?B++OH- |
| B、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C、中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D、将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
原电池产生电流的本质原因是( )
| A、原电池中溶液能电离出自由移动的离子 |
| B、有导线将两个活动性不同的电极连接 |
| C、正极发生了氧化反应,而负极发生了还原反应 |
| D、两电极上分别进行的氧化、还原反应中会有电子的转移 |
下列说法正确的是( )
| A、NaOH溶于水共价键被破坏 |
| B、稀有气体的原子间存在共价键 |
| C、二氧化碳分子的结构式:O═C═O |
| D、MgF2、H2O2含有的化学键类型相同 |
分离苯和苯酚的混合物,通常采用的方法是( )
| A、振荡混合物,用分液漏斗分离 |
| B、加水振荡后,用分液漏斗分离 |
| C、加稀盐酸振荡后,用分液漏斗分离 |
| D、加入NaOH溶液后振荡,用分液漏斗分离,取下层液体通入CO2,待分层后分离 |
下列有关实验中叙述不正确的是( )
| A、向2mL 5% H2O2溶液中滴入0.1 mol/L FeCl3溶液1 mL,能较快的产生气体 |
| B、向KMnO4酸性溶液中加入过量草酸溶液,溶液紫红色褪去 |
| C、向酸性K2Cr2O7溶液中加入适量的NaOH溶液,溶液由黄色变为橙色 |
| D、向5mL 0.1mol/L Na2S2O3溶液中加入稀H2SO4,一段时间后溶液变浑浊 |
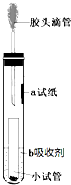 一位同学设计了一套微型装置(如图),用来完成下列实验.
一位同学设计了一套微型装置(如图),用来完成下列实验.