题目内容
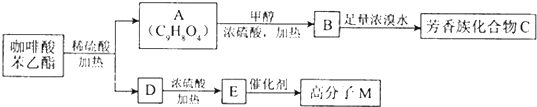
短周期主族元素X、Y、Z、M、W在元素周期表中的相对位置如表,其中Z的核电荷数是Y 的两倍.下列说法正确的是( )
| X | Y | |
| W | M | Z |
| A、M位于元素周期表中第三周期ⅣA族 |
| B、原子半径:Z>M>X |
| C、气态氢化物的热稳定性:Y>X>W |
| D、W的氧化物既能与NaOH反应,也能与HF反应,属于两性氧化物 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:依据表格所知:X、Y、Z、M、W是短周期主族元素,那么X、Y应为第二周期元素,W、M、Z应为第三周期元素,又知Z的核电荷数是Y的两倍,那么Y为氧元素,Z为硫元素,据此得知X为氮元素、M磷元素、W为硅元素,据此判断即可.
解答:
解:依据分析可知:X为氮元素、Y为氧元素、W为硅元素、M为磷元素、W为硅元素,
A、M为磷元素,处于第三周期第ⅣA族,故A错误;
B、同一周期,原子序数越大,半径越小,同一主族,电子层数越多,半径越大,故应是M>Z>X,故B错误;
C、元素的非金属性越强,其气态氢化物的稳定性越大,由于非金属性O>N>Si,故C正确;
D、二氧化硅是酸性氧化物,其与HF的反应不表现其碱性氧化物的性质,故D错误,故选C.
A、M为磷元素,处于第三周期第ⅣA族,故A错误;
B、同一周期,原子序数越大,半径越小,同一主族,电子层数越多,半径越大,故应是M>Z>X,故B错误;
C、元素的非金属性越强,其气态氢化物的稳定性越大,由于非金属性O>N>Si,故C正确;
D、二氧化硅是酸性氧化物,其与HF的反应不表现其碱性氧化物的性质,故D错误,故选C.
点评:本题主要考查的是元素的推断以及元素周期律的应用,准确利用条件得出各种元素是解决本题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A、常温常压下,22.4L CH4中含有4NA个C-H键 |
| B、48g O3气体含有3NA个氧原子 |
| C、在1L0.5mol?L-1FeCl3溶液中含有0.5NA个Fe3+ |
| D、标准状况下,2.24LCCl4含有的分子数为0.1NA |
下列各组离子在水溶液中因发生氧化还原反应而不能大量共存的是( )
| A、H+、K+、CO32-、HCO3- |
| B、Na+、Fe3+、Cl-、I- |
| C、K+、Al3+、NO3-、AlO2- |
| D、K+、Br-、HCO3-、CO32- |
研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式.以下用于研究有机物的方法中正确的是( )
| A、重结晶法一般适用于被提纯的有机物在溶剂中的溶解度受温度影响较大的混合物的分离 |
| B、对有机物分子红外光谱图的研究有助于确定有机物相对分子质量 |
| C、燃烧法是确定有机物分子官能团的有效方法 |
| D、质谱法通常用于分析确定有机物分子的元素组成 |
用石墨作电极电解0.1mol?L-1的CuSO4溶液,当有0.4mol电子通过电路时,发现阴极增重6.4g,则要使电解后的溶液恢复到原始状态,则应向电解后的溶液中加入( )
| A、0.1molCu(OH)2 |
| B、0.1molCuO |
| C、0.2molCuO |
| D、0.1molCuO和0.2molH2O |

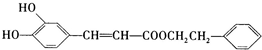 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化: