题目内容
2.燃烧1g乙炔生成二氧化碳和液态水放出热量50kJ,则下列热化学方程式书写正确的是( )| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+50 kJ•mol-1 | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1 300 kJ | |
| C. | 2C2H2+5O2═4CO2+2H2O△H=-2 600 kJ | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2 600 kJ•mol-1 |
分析 根据n=$\frac{m}{M}$计算出1g乙炔的物质的量,然后计算出2mol乙炔完全燃烧生成二氧化碳和液态水放出热量,然后写出乙炔燃烧的热化学方程式.
解答 解:1g乙炔的物质的量为:$\frac{1g}{26g/mol}$=$\frac{1}{26}$mol,则2mol乙炔完全燃烧生成二氧化碳和液态水放出热量为:50kJ×$\frac{2mol}{\frac{1}{26}mol}$=2 600 kJ,
所以乙炔燃烧的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2600 kJ•mol-1,故A错误、D正确;
B.焓变的单位错误,应该为1300kJ•mol-1,故B错误;
C.热化学方程式中必须标出各物质的状态,故C错误;
故选D.
点评 本题考查了热化学方程式的书写,题目难度不大,明确热化学方程式的书写原则为解答关键,B为易错点,注意焓变的单位,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
13.下列关于有机物的说法正确的是( )
| A. | 聚丙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 分馏石油得到的各馏分都是纯净物 | |
| C. | C4H10有2种同分异构体 | |
| D. | 蛋白质水解和油脂皂化都是高分子转化成小分子的过程 |
10.下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是( )
| A. | Ba2+、NO3-、NH4+、Cl- | B. | Mg2+、NH4+、SO42-、K+ | ||
| C. | K+、Ba2+、Cl-、HSO3- | D. | Ca2+、HCO3-、NH4+、Al3+ |
17.磷酸分子间脱水会形成多种聚磷酸,它们的钠盐是广泛使用的食品添加剂.将48gNaOH与58.8g固态纯H3PO4在一定温度下加热,得到79.8g固体A和27g水,则A可能是( )
| A. | Na3PO4 | B. | Na3PO3 | ||
| C. | Na4P2O7 和Na5P3O10 | D. | Na3PO4、Na4P2O7和Na5P3O10 |
7.下列关于物质性质变化的比较,不正确的是( )
| A. | 还原性强弱:F->Cl->I- | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 稳定性强弱:HF>HCl>HBr |
14.下列有关核外电子排布的式子不正确的是( )
| A. | 24Cr的电子排布式:1s22s22p63s23p63d54s1 | |
| B. | K的简化电子排布式:[Ar]4s1 | |
| C. | N原子的电子排布图: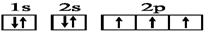 | |
| D. | S原子的电子排布图: |
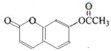
11. 某有机物的结构简式如图,取足量的H2、NaOH溶液和溴水分别和等物质的量的该物质在一定条件下反应(必要时可以加热),完全反应后消耗的H2、NaOH和Br2三种物质的物质的量之比是( )
某有机物的结构简式如图,取足量的H2、NaOH溶液和溴水分别和等物质的量的该物质在一定条件下反应(必要时可以加热),完全反应后消耗的H2、NaOH和Br2三种物质的物质的量之比是( )
 某有机物的结构简式如图,取足量的H2、NaOH溶液和溴水分别和等物质的量的该物质在一定条件下反应(必要时可以加热),完全反应后消耗的H2、NaOH和Br2三种物质的物质的量之比是( )
某有机物的结构简式如图,取足量的H2、NaOH溶液和溴水分别和等物质的量的该物质在一定条件下反应(必要时可以加热),完全反应后消耗的H2、NaOH和Br2三种物质的物质的量之比是( )| A. | 3:4:1 | B. | 5:4:1 | C. | 3:5:1 | D. | 3:5:0 |
12.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 9gD2O和9gH2O中含有的质子数均为5NA | |
| B. | 2L0.5mol/LH2SO3溶液中含有的H+数小于2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
 .
. .
.