题目内容
17.某校研究性学习小组的同学设计了如图所示的实验装置(夹持及尾气处理装置未画出)来探究氨气的性质.A中是氯化铵和氢氧化钙固体,C中盛Wg固体氧化铜.实验时观察到C中CuO变为红色,D中无水CuSO4变蓝,同时生成一种无污染的气体.
回答下列问题:
(1)B中碱石灰的作用是除去NH3中的水蒸气.
(2)氨气与CuO反应的化学方程式为 2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu.该反应中氨的作用是还原剂(填氧化剂或还原剂).
(3)有同学认为NH3与CuO反应生成的红色物质中可能含Cu2O.Cu2O在酸性溶液中Cu+歧化生成Cu和Cu2+.请设计一个简单的实验检验该红色物质中是否含有Cu2O取少许样品,加入稀H2SO4,若溶液出现蓝色,说明含有Cu2O,反之则没有.
(4)若实验前后D装置的质量差为ag,则制得的铜的纯度为$\frac{64a}{18W-16a}$×100%(用含a和 W的式子表示)
分析 A中是氯化铵和氢氧化钙固体加热反应生成氨气,通过装置B中的碱石灰干燥氨气,通过装置C氨气和氧化铜加热发生氧化还原反应,C中盛Wg固体氧化铜.实验时观察到C中CuO变为红色,说明生成了金属铜,D中无水CuSO4变蓝证明生成产物中有水,同时生成一种无污染的气体,结合元素守恒得到为氮气.
(1)氨气是碱性气体,干燥用碱石灰;
(2)氨气通过和氧化铜加热,实验时观察到C中CuO变为红色,说明生成了金属铜,D中无水CuSO4变蓝证明生成产物中有水,同时生成一种无污染的气体,结合元素守恒得到为氮气,据此书写化学方程式,氧化还原反应中元素化合价升高的反应物做还原剂,元素化合价降低的反应物做氧化剂;
(3)Cu20是一种碱性氧化物,在酸性溶液中Cu+生成Cu+Cu2+,据此反应的现象设计实验验证是否含有氧化亚铜;
(4)若实验前后D装置的质量差为ag为生成的水,依据氧元素守恒计算铜元素质量,依据水的质量和化学方程式计算生成铜的质量,得到铜的纯度;
解答 解:(1)B中碱石灰的作用是除去NH3中的水蒸气,
故答案为:除去NH3中的水蒸气;
(2)氨气与CuO反应生成铜、氮气和水,化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,氨气中氮元素化合价-3价变化为0价做还原剂,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;还原剂;
(3)Cu20是一种碱性氧化物,在酸性溶液中Cu+生成Cu+Cu2+,据此反应设计实验验证是否含有氧化亚铜,步骤为:取少量样品,加入稀硫酸,若溶液出现蓝色,说明含有Cu2O,否则不含有,
故答案为:取少许样品,加入稀H2SO4,若溶液出现蓝色,说明含有Cu2O,反之则没有;
(4)若实验前后D装置的质量差为ag为水的质量,元素守恒计算原氧化铜中铜的质量,Wg-$\frac{ag}{18g/mol}×16g/mol$=(W-$\frac{16a}{18}$)g
化学方程式计算3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O
3 3
n $\frac{ag}{18g/mol}$
n=$\frac{a}{18}$g
则制得的铜的纯度=$\frac{\frac{a}{18}g}{Wg-\frac{16a}{18}g}$×100%=$\frac{64a}{18W-16a}$×100%,
故答案为:$\frac{64a}{18W-16a}$×100%;
点评 本题考查了氨气实验室制备方法,氨气的性质验证实验设计用于分析判断,熟悉制备原理是解题关键,注意实验设计的合理性,题目难度不大.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 海带中含有碘元素 | |
| B. | 海水中含有大量氯元素 | |
| C. | 蒸馏法是海水淡化的主要方法之一 | |
| D. | 开发海水资源可以不考虑是否对环境有污染 |
| A. | 石油的分馏、煤的干馏都是属于物理变化 | |
| B. | 淀粉、纤维素、油脂、蛋白质都是天然有机高分子化合物 | |
| C. | 蛋白质溶液遇硫酸铵溶液和硫酸铜溶液后都产生的沉淀,且原理相同 | |
| D. | 植物油能使溴的四氯化碳溶液褪色 |
| A. | 溶液的c(H+)=10-7 mol/L | B. | 溶液的溶质为盐 | ||
| C. | 溶液中既含有H+又含有OH- | D. | 混合溶液中,pH=-$\frac{lg{K}_{w}}{2}$ |
| A. | 在人体内,油脂在脂肪酶催化作用下水解为高级脂肪酸和甘油 | |
| B. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| C. | 以液化石油气代替燃油可减少大气污染 | |
| D. | 医用消毒酒精中乙醇的浓度为95% |
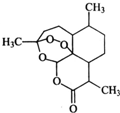 中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )| A. | 有“-O-”键,分子式C15H22O5,可发生取代反应 | |
| B. | 有“六元环”结构,是苯的同系物,可发生加成反应 | |
| C. | 有“-O-O-”键,氧化性较强,可发生还原反应 | |
| D. | 有“-COOC-”键,碱性条件下,可发生水解反应 |
| A. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | |
| B. | 同浓度的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③ | |
| C. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL |
 ,其中甲、乙、丁均能发生银镜反应,则乙为( )
,其中甲、乙、丁均能发生银镜反应,则乙为( )| A. | 甲醇 | B. | 甲醛 | C. | 乙醛 | D. | 甲酸 |
已知:(1)酸性强弱:HCl>苯甲酸>H2CO3>苯酚>HCO3-
(2)部分物理参数如下:
| 密度 (g•mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 苯甲酸 | 1.2659 | 122.13 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯酚 | 1.07 | 40.6 | 181.9 | 易溶于乙醇、乙醚,65℃以上能与水互溶 |
| 乙醇 | 0.79 | -114.3 | 78.5 | 与水混溶,可混溶于醚、氯仿、甘油等多数有 机溶剂 |
(1)分离物质流程如下:
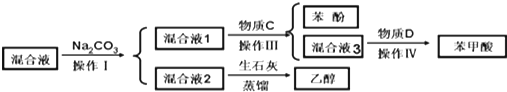
物质C是CO2,操作IV是过滤.
(2)操作III发生的主要化学反应方程式
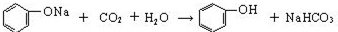 .
.(3)混合液2中加入生石灰的原因是生石灰与混合液2中的水反应,生成氢氧化钙溶液,并放出热量,便于乙醇从混合物中蒸馏出.
(4)该同学检验混合液1中是否含有苯酚和NaHCO3,以证明酸性的强弱.完成下列各步实验及实验现象和结论.
| 实验步骤 | 现象和结论 |
| ①取少量混合液1于试管,滴加BaCl2, 振荡,静置 | 产生白色沉淀,BaCO3 |
| ②取少量步骤①上层清夜于试管,滴加0.1mol/L盐酸再将产生的气体通入澄清石灰水中 | 澄清石灰水变浑浊 说明混合液1含有HCO3- |
| ③另取少量混合液1于试管,滴加0.1mol/L FeCl3溶液,振荡 | 溶液不显紫色, 说明混合液1不含有酚羟基 |