题目内容
4.同一还原剂与多种氧化剂在一起时,先与氧化性强的粒子反应,待强的反应完后,再与氧化性弱的反应,称为反应先后规律.已知氧化性:Fe3+>Cu2+,在溶有Fe2(SO4)3和CuSO4的溶液中加入铁粉,下列说法中不正确的是( )| A. | 若铁粉有剩余,则不溶物中一定有铜 | |
| B. | 若铁粉有剩余,则溶液中的金属阳离子只有Fe2+ | |
| C. | 若铁粉无剩余,且溶液中有Cu2+,则溶液中一定无Fe3+ | |
| D. | 若铁粉无剩余,且溶液中无Cu2+,则溶液中一定有Fe2+,一定无Fe3+ |
分析 依据氧化还原反应的先后规律:同一还原剂与多种氧化剂在一起时,先与氧化性强的粒子反应,待强的反应完后,再与氧化性弱的反应,称为反应先后规律,三价铁离子氧化性强于铜离子,加入铁粉,铁粉先与三价铁离子反应生成二价铁离子,剩余铁粉再与铜离子反应生成二价铁离子,据此分析.
解答 解:三价铁离子氧化性强于铜离子,加入铁粉,铁粉先与三价铁离子反应生成二价铁离子,剩余铁粉再与铜离子反应生成二价铁离子,
A.若有铁粉剩余,则三价铁离子、铜离子完全反应,不容物中一定含有铜,故A正确;
B.若有铁粉剩余,则三价铁离子、铜离子完全反应,则溶液中的金属阳离子只有Fe2+,故B正确;
C.若铁粉无剩余,且溶液中有Cu2+,则可能有三种情况,一种为铜离子只反应一部分,则三价铁离子完全反应,一种为铜离子未反应,则三价铁离子恰好反应,一种为铜离子未反应,三价铁离子只反应一部分,溶液中含有三价铁离子,故C错误;
D.若铁粉无剩余,且溶液中无Cu2+,因为三价铁离子先于铁粉反应,所以一定不含三价铁离子,一定含有二价铁离子,故D正确;
故选:C.
点评 本题考查了离子推断,明确氧化还原反应先后规律,熟悉三价铁离子、铜离子性质是解题关键,题目难度不大.

练习册系列答案
相关题目
18.下列关于药物的叙述中,错误的是( )
| A. | 阿司匹林只有解热镇痛有作用,只能用于治疗感冒 | |
| B. | 青霉素是消炎药,有阻止多种细菌生长的优异功能.使用前一定要进行皮肤敏感试验 | |
| C. | 抗酸药能中和胃液中过多的盐酸,缓解胃部不适的症状 | |
| D. | 天然药物取自植物、动物和矿物,来源丰富,有广阔的开发前景 |
19.25℃时,向25mL 0.1mol•L-1H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )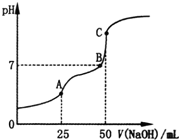

| A. | HC2O4-的电离程度大于其水解程度 | |
| B. | B点时溶液中含有Na2HC2O4和Na2C2O4 | |
| C. | C点时,c(Na+)>c(C2O42-)>c(HC2O4- )>c(OH-)>c(H+) | |
| D. | A点时,c(Na+)+c(H+)═c(OH-)+c(HC2O4-)+2c(C2O42-) |
16.有机物X的分子式为C6H12O2,其水解可得到CH3OH,则X的结构有(考虑立体异构)( )种.
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
3.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
滴定时,你认为该滴定适宜选用的指示剂是下列中的 ( )
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
| A. | KBr | B. | KI | C. | K2S | D. | K2CrO4 |
9. X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Y位于元素周期表第三周期第VIA族,Y和Z的最高价氧化物对应的水化物的酸性较强的是HClO4(写化学式).
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)W的基态原子价电子排布式是3d104s1.
工业上以W2Y为原料制备W的化学方程式为Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2Cu+2SO2 ,通过该方法冶炼得到的W的单质含有锌、铁、镍、银、金等杂质,除去这些杂质常用的方法叫电解精炼,请标出右图所示装置中电极材料名称及电解质溶液名称.
(4)W形成的氧化物W2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有16个W原子.
 X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)W的基态原子价电子排布式是3d104s1.
工业上以W2Y为原料制备W的化学方程式为Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2Cu+2SO2 ,通过该方法冶炼得到的W的单质含有锌、铁、镍、银、金等杂质,除去这些杂质常用的方法叫电解精炼,请标出右图所示装置中电极材料名称及电解质溶液名称.
(4)W形成的氧化物W2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有16个W原子.
14.氢氧化镁用于制药工业,还是重要的绿色阻燃剂.
Ⅰ.治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2.
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子式方程式为Mg(OH)2+2H+=Mg2++2H2O;
Ⅱ.已知:
H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H1=+242kJ•mol-1
Mg(s)+2H2O(g)=Mg(OH)2(s)+H2(g)△H2=-441kJ•mol-1
Mg(s)+$\frac{1}{2}$O2(g)=MgO(s)△H3=-602kJ•mol-1
(2)氢氧化镁分解的热化学方程式为Mg(OH)2(s)=MgO(s)+H2O(g);△H=81KJ/mol;
Ⅲ.某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制.获得阻燃剂氢氧化镁.
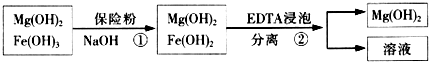
(3)步骤①中加入保险粉(Na2S2O4)的作用:将氢氧化铁还原为氢氧化亚铁.
(4)已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(OH)2反应.虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2.请从沉淀溶解平衡的角度加以解释Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2(s)=Fe2+(aq)+2OH-(aq)当不断滴入EDTA时,EDTA将结合Fe 2+促使平衡向右移动而使Fe(OH)2不断溶解;
Ⅳ.为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳提纯条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,结果如下:
(5)若不考虑其它条件,根据上表数据,制取高纯度阻燃剂最佳条件是C(填字母).
①40℃②60℃③EDTA质量为0.05g④EDTA质量为0.10g ⑤保险粉质量为0.05g ⑥保险粉质量为0.10g
A.①③⑤B.②④⑥C.①④⑥D.②③⑤
Ⅰ.治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2.
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子式方程式为Mg(OH)2+2H+=Mg2++2H2O;
Ⅱ.已知:
H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H1=+242kJ•mol-1
Mg(s)+2H2O(g)=Mg(OH)2(s)+H2(g)△H2=-441kJ•mol-1
Mg(s)+$\frac{1}{2}$O2(g)=MgO(s)△H3=-602kJ•mol-1
(2)氢氧化镁分解的热化学方程式为Mg(OH)2(s)=MgO(s)+H2O(g);△H=81KJ/mol;
Ⅲ.某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制.获得阻燃剂氢氧化镁.
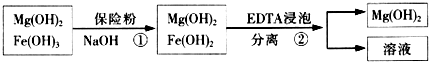
(3)步骤①中加入保险粉(Na2S2O4)的作用:将氢氧化铁还原为氢氧化亚铁.
(4)已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(OH)2反应.虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2.请从沉淀溶解平衡的角度加以解释Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2(s)=Fe2+(aq)+2OH-(aq)当不断滴入EDTA时,EDTA将结合Fe 2+促使平衡向右移动而使Fe(OH)2不断溶解;
Ⅳ.为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳提纯条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,结果如下:
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
①40℃②60℃③EDTA质量为0.05g④EDTA质量为0.10g ⑤保险粉质量为0.05g ⑥保险粉质量为0.10g
A.①③⑤B.②④⑥C.①④⑥D.②③⑤
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极.接通电源,经过一段时间后,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极.接通电源,经过一段时间后,乙中c电极质量增加.据此回答问题: