题目内容
19.25℃时,向25mL 0.1mol•L-1H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )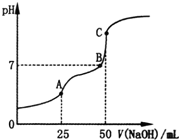
| A. | HC2O4-的电离程度大于其水解程度 | |
| B. | B点时溶液中含有Na2HC2O4和Na2C2O4 | |
| C. | C点时,c(Na+)>c(C2O42-)>c(HC2O4- )>c(OH-)>c(H+) | |
| D. | A点时,c(Na+)+c(H+)═c(OH-)+c(HC2O4-)+2c(C2O42-) |
分析 A.25mL时,二者恰好完全反应生成NaHC2O4,溶液呈酸性,溶液中HC2O4-既能电离也能水解,结合溶液酸碱性判断该HC2O4-水解和电离程度相对大小;
B.A点溶液中溶质为NaHC2O4,C点溶液中溶质为Na2C2O4;
C.C点二者恰好完全反应生成Na2C2O4,C2O42-两步水解都生成OH-,第一步水解程度远远大于第二步水解程度;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:A.25mL时,二者恰好完全反应生成NaHC2O4,溶液中HC2O4-既能电离也能水解,溶液呈酸性,说明溶液中HC2O4-电离程度大于水解程度,故A正确;
B.A点溶液中溶质为NaHC2O4,C点溶液中溶质为Na2C2O4,B点介于二者之间,则溶液中溶质为Na2HC2O4和Na2C2O4,故B正确;
C.C点二者恰好完全反应生成Na2C2O4,C2O42-两步水解都生成OH-,第一步水解程度远远大于第二步水解程度,所以溶液中c(HC2O4- )<c(OH-),故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)═c(OH-)+c(HC2O4-)+2c(C2O42-),故D正确;
故选C.
点评 本题以酸碱混合溶液定性判断为载体考查离子浓度大小比较,为高频考点,明确图中溶液中溶质成分及其性质、溶液酸碱性是解本题关键,侧重考查学生分析判断能力,题目难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
7.已知维生素 A 的结构简式如下,有关它的说法正确的是 ( )


| A. | 维生素A是一种易溶于水的醇 | |
| B. | 维生素A的一个分子中含有5个碳碳双键 | |
| C. | 维生素A具有环己烷的结构单元 | |
| D. | 维生素A能发生加成、氧化、酯化等反应 |
14.Wolff-Kishner-黄鸣龙反应是醛类或酮类在碱性条件下与肼作用,使得>C═O转化为-CH2-.如:
 +H2N-NH2$→_{△}^{NaOH/(HOCH_{2}CH_{2})_{2}O}$
+H2N-NH2$→_{△}^{NaOH/(HOCH_{2}CH_{2})_{2}O}$ +X(g)+Y(l)
+X(g)+Y(l)
其中,X和Y不污染环境,下列说法中不正确的是( )
 +H2N-NH2$→_{△}^{NaOH/(HOCH_{2}CH_{2})_{2}O}$
+H2N-NH2$→_{△}^{NaOH/(HOCH_{2}CH_{2})_{2}O}$ +X(g)+Y(l)
+X(g)+Y(l)其中,X和Y不污染环境,下列说法中不正确的是( )
| A. | 肼作还原剂 | B. | X是N2 | ||
| C. | Y是H2O | D. |  在酸性条件下水解为苯甲酸和乙醇 在酸性条件下水解为苯甲酸和乙醇 |
4.全世界各国运动会上都禁止运动员服用兴奋剂,这是保证公正公平的基本要求;如图是某种兴奋剂的结构简式,有关该物质的说法正确的是 ( )

| A. | 该分子中所有碳原子一定都在一个平面上 | |
| B. | 该分子遇FeCl3溶液显紫色,但与苯酚不属于同系物 | |
| C. | 1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol | |
| D. | 滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键. |
4.同一还原剂与多种氧化剂在一起时,先与氧化性强的粒子反应,待强的反应完后,再与氧化性弱的反应,称为反应先后规律.已知氧化性:Fe3+>Cu2+,在溶有Fe2(SO4)3和CuSO4的溶液中加入铁粉,下列说法中不正确的是( )
| A. | 若铁粉有剩余,则不溶物中一定有铜 | |
| B. | 若铁粉有剩余,则溶液中的金属阳离子只有Fe2+ | |
| C. | 若铁粉无剩余,且溶液中有Cu2+,则溶液中一定无Fe3+ | |
| D. | 若铁粉无剩余,且溶液中无Cu2+,则溶液中一定有Fe2+,一定无Fe3+ |
5.下列关于氧化还原反应的说法错误的是( )
| A. | KClO3+6HCl═3Cl2↑+KCl+3H2O反应中还原剂与氧化剂的物质的量之比为6:1 | |
| B. | 硝酸铵受热分解的化学方程式为:5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子数之比为5:3 | |
| C. | 工业上制备新型净水剂高铁酸钾(K2FeO4)的一步反应如下:2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O,若有2 mol FeCl3发生反应,转移电子的物质的量为6 mol | |
| D. | 氮化铝广泛应用于电子陶瓷等工业领域.在一定条件下,AlN可通过反应:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO合成,方程式中AlN中氮的化合价为-3 |
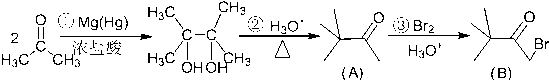
 .
. ,则该同分异构体的结构简式为:
,则该同分异构体的结构简式为: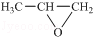 .
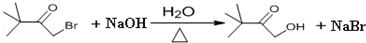
.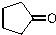 )来代替丙酮,连续发生上述路线中反应①、②之后,得到的有机产物的结构简式为:
)来代替丙酮,连续发生上述路线中反应①、②之后,得到的有机产物的结构简式为: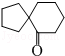 .
.