题目内容
1.下列物质中,不会出现丁达尔效应的分散系是( )①氢氧化铁胶体②水③豆浆④蔗糖溶液⑤FeCl3溶液⑥云、雾.
| A. | ②④⑤ | B. | ③④ | C. | ②④⑥ | D. | ④①③ |
分析 丁达尔现象是胶体特有的性质和现象,分散系是胶体就具有丁达尔现象,据此分析.
解答 解:①氢氧化铁胶体 ③豆浆 ⑥云、雾均属于胶体分散系,均具有丁达尔现象,②水 ④蔗糖溶液 ⑤FeCl3溶液,均无丁达尔效应,故选A.
点评 本题考查了胶体的性质应用和分散系的判断,难度不大,熟悉常见的胶体分散系是解答本题的关键,注意丁达尔效应是胶体特有的性质.

练习册系列答案
相关题目
11.“84消毒液”能有效杀灭甲型H7N9病毒,某同学参阅“84消毒液”说明中的配方,欲用NaClO固体自己配制480mL含NaClO 25%,密度为1.2g•cm-3的消毒液,下列说法正确的是( )
| A. | 需要称量NaClO固体的质量为144.0 g | |
| B. | 如图所示的仪器中,有四种是不需要的,另外还需一种玻璃仪器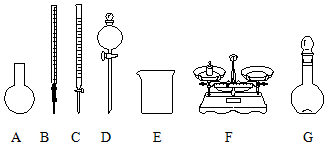 | |
| C. | 配制的溶液在空气中光照,久置后溶液中NaClO的物质的量浓度减小 | |
| D. | 容量瓶用蒸馏水洗净后应烘干才能用于溶液配制,否则结果偏低 |
9.下列说法正确的是( )
| A. | 3O2(g)=2O3(g)△H>0,则可判定O2(g)比O3(g)稳定 | |
| B. | 由1 mol H2形成2 mol H要放出热量 | |
| C. | 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热Q kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-2Q kJ/mol | |
| D. | 已知Ni(CO)4(g)=Ni(s)+4CO(g)△H=Q kJ/mol,则Ni(s)+4CO(g)=Ni(CO)4(g)△H=-Q kJ/mol |
16.氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡.
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=a kJ•mol-1.
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如表:
此反应的a>0,△S>0.(填“>”“<”或“=”)
(2)一定温度和压强下,在2L的恒容密闭容器中合成氨气:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在反应过程中反应物和生成物的物质的量随时间的变化如图所示.
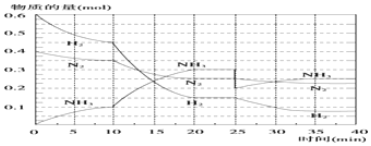
①0~10min内,以NH3表不的平均反应速率为0.005mol•L-1•min-1.
②在10~20min内,NH3浓度变化的原因可能是AB.
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③在反应进行至25min时,曲线发生变化的原因是移走0.1molNH3,达到第二次平衡时,新平衡的平衡常数K2=K1(填“>”“<”或“=”)
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=a kJ•mol-1.
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如表:
| T/K | 303 | 313 | 323 |
| n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
(2)一定温度和压强下,在2L的恒容密闭容器中合成氨气:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在反应过程中反应物和生成物的物质的量随时间的变化如图所示.

①0~10min内,以NH3表不的平均反应速率为0.005mol•L-1•min-1.
②在10~20min内,NH3浓度变化的原因可能是AB.
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③在反应进行至25min时,曲线发生变化的原因是移走0.1molNH3,达到第二次平衡时,新平衡的平衡常数K2=K1(填“>”“<”或“=”)
6.25℃时,0.1mol•L-1的某一元弱酸溶液中酸的电离度为a%,则该溶液的pH为( )
| A. | 1 | B. | 1-a | C. | 2-lg a | D. | 3-lg a |
13.以下是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述正确的是( )
饱和食盐水$→_{Ⅰ}^{通入足量的气体A}$A和食盐的饱和溶液$→_{Ⅱ}^{通入过量的气体B}$悬浊液$→_{Ⅲ}^{过滤}$晶体$\stackrel{Ⅳ}{→}$纯碱.
饱和食盐水$→_{Ⅰ}^{通入足量的气体A}$A和食盐的饱和溶液$→_{Ⅱ}^{通入过量的气体B}$悬浊液$→_{Ⅲ}^{过滤}$晶体$\stackrel{Ⅳ}{→}$纯碱.
| A. | 第Ⅱ步的离子方程式为Na++NH3.H2O+CO2═NaHCO3↓+NH4+ | |
| B. | 第Ⅲ步得到的晶体是Na2CO3•10H2O | |
| C. | A气体是CO2,B气体是NH3 | |
| D. | 第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
10.下列物质中属于烷烃的是( )
| A. | 乙烷 | B. | 丙烯 | C. | 丙烷 | D. | 丁烷 |
 .
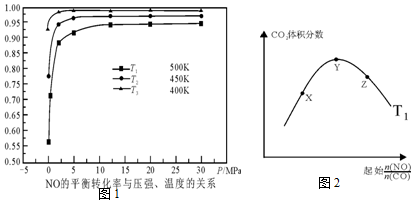
.
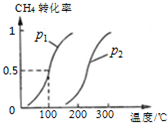 甲烷,甲醇,乙酸是化工产品的重要原料.
甲烷,甲醇,乙酸是化工产品的重要原料.