题目内容
5.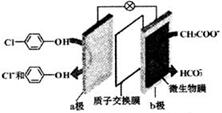 利用微生物电池处理含乙酸钠和对氯酚(
利用微生物电池处理含乙酸钠和对氯酚(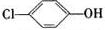 )的废水,工作原理如图所示.下列说法正确的是( )
)的废水,工作原理如图所示.下列说法正确的是( )| A. | 电极b是正极 | B. | 质子从a极移向b极 | ||
| C. | 处理后的废水pH升高 | D. | a极的电极反应式: |
分析 原电池工作时,正极上发生得电子的还原反应,负极上发生失电子的还原反应,a是正极,正极上发生得电子的还原反应: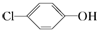 +2e-+H+═
+2e-+H+═ -OH+Cl-,b为负极,反应:CH3COO--8e-+2H2O=2CO2+7H+,以此解答该题.
-OH+Cl-,b为负极,反应:CH3COO--8e-+2H2O=2CO2+7H+,以此解答该题.
解答 解:A.正极上发生得电子的还原反应,a上发生得电子的还原反应: +2e-+H+═
+2e-+H+═ -OH+Cl-,所以a是正极,b为负极,故A错误;
-OH+Cl-,所以a是正极,b为负极,故A错误;
B.阳离子从负极移向正极,则H+从b极移向a极,故B错误;
C.由电极方程式可知当转移8mol电子时,正极消耗4molH+,负极生成7molH+,则处理后的废水pH降低,故C错误;
D.a是正极,正极上发生得电子的还原反应: +2e-+H+═
+2e-+H+═ -OH+Cl-,故D正确.
-OH+Cl-,故D正确.
故选D.
点评 本题考查新型电池,题目难度中等,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据物质的性质判断原电池的正负极.

练习册系列答案
相关题目
10.化学与生活紧密联系,下列说法不正确的是( )
| A. | Na2SiO3水溶液俗称水玻璃,可用作木材防火剂 | |
| B. | Fe3O4俗称铁红,可用作红色涂料 | |
| C. | Na2CO3俗称纯碱,可作为制造玻璃的原料 | |
| D. | KAl(SO4)2•12H2O俗称明矾,可作为净水剂 |
14.向2.9g某饱和一元醛中加人足量银氨溶液,在一定条件下充分反应后析出10.8g银,该醛是( )
| A. | HCHO | B. | CH3CHO | C. | CH3CH2CHO | D. | CH3CH(CH3)CHO |
19.已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是( )
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | W含氧酸的酸性一定比Z的含氧酸的酸性强 | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |



 .
. .
. .
.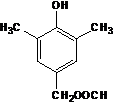 或
或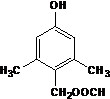 .
.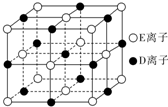 A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子.G元素与D元素同主族,且相差3个周期.
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子.G元素与D元素同主族,且相差3个周期.
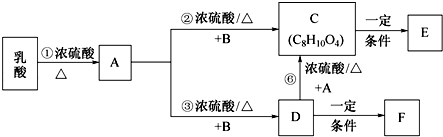
 .
. .
. .
. 将1.800g FeC2O4•2H2O固体样品放在热重分析仪中进行热重分析,测得其热重分析 曲线(样品质量随温度变化的曲线)如图所示
将1.800g FeC2O4•2H2O固体样品放在热重分析仪中进行热重分析,测得其热重分析 曲线(样品质量随温度变化的曲线)如图所示