题目内容
8.下列物质在一定条件下形成晶体:①水晶②金刚石③碳化硅④白磷⑤晶体氩⑥氢氧化钠⑦铝⑧氧化钙⑨过氧化钠⑩碳化钙⑪冰醋酸⑫干冰⑬过氧化氢.请用序号回答:(1)属于原子晶体的化合物①③.
(2)由极性分子构成的晶体是⑪⑫⑬,含有非极性键的离子晶体是⑨⑩.
分析 原子间通过共价键结合形成的空间网状结构的晶体属于原子晶体;分子间通过分子间作用力结合形成的晶体为分子晶体,不同非金属原子之间形成极性键,同种非金属原子之间形成非极性键,据此分析.
解答 解:①水晶属于原子晶体,O-Si原子间形成极性键,属于化合物;
②金刚石属于原子晶体,存在C-C非极性键,属于单质;
③碳化硅属于原子晶体,存在Si-C极性键,属于化合物;
④白磷属于分子晶体,存在非极性键;
⑤晶体氩属于分子晶体,分子中没有化学键;
⑥氢氧化钠属于离子晶体,存在极性键和离子键;
⑦铝属于金属晶体,存在金属键;
⑧氧化钙属于离子晶体,存在离子键;
⑨过氧化钠属于离子晶体,存在离子键和非极性键;
⑩碳化钙属于离子晶体,存在离子键;
⑪冰醋酸属于分子晶体,存在极性键和非极性键;
⑫干冰属于分子晶体,存在极性键;
⑬过氧化氢属于分子晶体,存在极性键和非极性键;
(1)属于原子晶体的化合物①③;
故答案为:①③;
(2)由极性分子构成的晶体是⑪⑫⑬,含有非极性键的离子晶体是⑨⑩;
故答案为:⑪⑫⑬;⑨⑩.
点评 本题考查晶体类型的判断、共价键的类型、化学键等,题目难度不大,注意知识的积累,注意把握晶体的构成微粒和微粒之间的作用力.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
19.下列化学用语正确的是( )
| A. | 硫离子的结构示意图: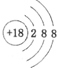 | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 电子转移情况: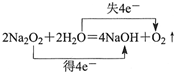 | D. | 氮分子的结构式:N≡N |
3.下列说法不正确的是( )
①NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
②含有共价键的晶体一定具有高的熔、沸点及硬度
③s-s σ键与s-p σ键的电子云形状相同
④含有π键的化合物与只含σ键的化合物的化学性质不同
⑤中心原子采取sp3杂化的分子,其立体构形不一定是正四面体
⑥配位键在形成时,是由成键双方各提供一个电子形成共用电子对.
①NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
②含有共价键的晶体一定具有高的熔、沸点及硬度
③s-s σ键与s-p σ键的电子云形状相同
④含有π键的化合物与只含σ键的化合物的化学性质不同
⑤中心原子采取sp3杂化的分子,其立体构形不一定是正四面体
⑥配位键在形成时,是由成键双方各提供一个电子形成共用电子对.
| A. | ①②⑤ | B. | ①④⑥ | C. | ②③⑤ | D. | ②③⑥ |
2.已知可逆反应:CO2(g)+2NH3(g)=H2O(g)+CO(NH2)2(s).在某密闭容器中只加入CO2和NH3,且n(CO2):n(NH3)=5:1.在某温度和压强下,平衡时NH3的转化率为20%.下列说法正确的是( )
| A. | 达到化学平衡时,n(CO2):n(NH3)=1:1 | |
| B. | 达到化学平衡时,n(CO2):n(H20)=1:1 | |
| C. | 达到化学平衡时,n[CO(NH2)2]:n(H20)=1:1 | |
| D. | 达到化学平衡时,n(NH3):n(H20)=1:1 |

 A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子.G元素与D元素同主族,且相差3个周期.
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子.G元素与D元素同主族,且相差3个周期.
 .
. .
. .
. 将1.800g FeC2O4•2H2O固体样品放在热重分析仪中进行热重分析,测得其热重分析 曲线(样品质量随温度变化的曲线)如图所示
将1.800g FeC2O4•2H2O固体样品放在热重分析仪中进行热重分析,测得其热重分析 曲线(样品质量随温度变化的曲线)如图所示