题目内容
19.下列叙述正确的是( )| A. | 使用催化剂能够降低化学反应的反应热△H | |
| B. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和NH3•H2O反应的中和热△H=2×(-57.3)kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)的△H=+2×283.0 kJ/mol |
分析 A、催化剂能降低反应的活化能从而改变反应速率,但不改变化学平衡;
B、氨水的电离是吸热过程,而且两者的物质的量不知;
C、可燃物的燃烧也需要加热,但属于放热反应;
D、根据燃烧热的定义、盖斯定律分析.
解答 解:A、催化剂能降低反应的活化能从而改变反应速率,但不改变化学平衡,则不能改变反应的反应热,故A错误;
B、氨水的电离是吸热过程,而且两者的物质的量不知,故B错误;
C、可燃物的燃烧也需要加热,但属于放热反应,故C错误;
D、CO(g)的燃烧热是283.0kJ/mol,CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol,因此2CO2(g)=2CO(g)+O2(g)的反应热为△H=+2×283.0kJ/mol,故D正确;
故选D.
点评 本题考查化学反应与能量问题,题目难度不大,注意反应吸热还是放热与反应条件无关、燃烧热等概念的理解.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
10.下列微粒中与OH-具有相同质子数和电子数的是( )
| A. | Na+ | B. | NH4+ | C. | Ne | D. | F- |
7.25℃时加水稀释10mL pH=11的氨水,下列判断正确的是( )
| A. | 原氨水的浓度为10-3mol•L-1 | |
| B. | 溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| C. | 氨水的电离程度增大,溶液中所有离子的浓度均减小 | |
| D. | 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7 |
14.下表中是各组反应的反应物和反应温度,反应刚开始时,放出H2速率最快的是( )
| 编号 | 金属(粉末状)(mol) | 酸的浓度及体积 | 反应温度(℃) | ||
| A | Al | 0.1 | 0.1mol•L-1 硫酸 | 10mL | 60 |
| B | Fe | 0.1 | 0.2mol•L-1盐酸 | 10mL | 60 |
| C | Al | 0.1 | 18mol•L-1 硫酸 | 10mL | 60 |
| D | Mg | 0.1 | 0.2mol•L-1 硝酸 | 10mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含20.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.65kJ | |
| B. | 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则标况下1mol氢气完全燃烧放出241.8 kJ的热量 | |
| C. | 已知2C(s)+2O2(g)=2CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)=2CO(g)△H=b kJ•mol-1,则a>b | |
| D. | 已知P (白磷,s)=P (红磷,s)△H<0,则白磷比红磷稳定 |
5.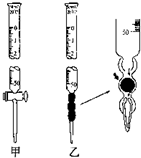 某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.
某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.
①用滴定的方法来测定盐酸的浓度,实验数据如表所示:
该未知盐酸的浓度为0.88mol•L-1(保留两位有效数字)
②滴定管如图所示,用乙滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”).
③下列操作会使所测得的盐酸的浓度偏低的是D.
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数.
 某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.
某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.①用滴定的方法来测定盐酸的浓度,实验数据如表所示:
| 实验编号 | 待测HCl溶液的体积/mL | 滴入NaOH溶液的体积/mL |
| 1 | 20.00 | 22.00 |
| 2 | 20.00 | 22.10 |
| 3 | 20.00 | 21.90 |
②滴定管如图所示,用乙滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”).
③下列操作会使所测得的盐酸的浓度偏低的是D.
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数.
2.硅孔雀石是一种含铜矿石,含铜形态为CuCO3、Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质.以其为原料制取硫酸铜的工艺流程如下图所示:
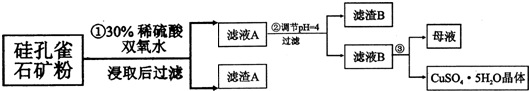
(1)步骤1中先加入足量稀硫酸,再加人双氧水.则双氧水参与该反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)步骤②调节溶液pH,可以选用的试剂是BC.(填字母编号)
A.A12O3 B.CuO C.CuCO3•Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
则滤液B中含有的阳离子是Al3+、H+、Cu2+.
(4)将滤液B通过蒸发浓缩、冷却结晶、过滤等操作可得到硫酸铜晶体.
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是CuS+2O2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CuSO4.取384g CuS在一定条件下和氧气完全反应,若发生2CuS+3O2=2CuO+2SO2和4CuS+5O2=2Cu2O+4SO2两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为bmol.则a=$\frac{2}{5}$b-8.(氧气占空气体积的五分之一)

(1)步骤1中先加入足量稀硫酸,再加人双氧水.则双氧水参与该反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)步骤②调节溶液pH,可以选用的试剂是BC.(填字母编号)
A.A12O3 B.CuO C.CuCO3•Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)将滤液B通过蒸发浓缩、冷却结晶、过滤等操作可得到硫酸铜晶体.
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是CuS+2O2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CuSO4.取384g CuS在一定条件下和氧气完全反应,若发生2CuS+3O2=2CuO+2SO2和4CuS+5O2=2Cu2O+4SO2两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为bmol.则a=$\frac{2}{5}$b-8.(氧气占空气体积的五分之一)
3.下列实验操作中,所用仪器使用合理的是( )
| A. | 在容量瓶中溶解氢氧化钠固体并配制溶液 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.2gNaCl | |
| D. | 用分液漏斗来过滤NaCl溶液中泥沙 |