题目内容
11.已知:①H2O(g)═H2O(l)△H=-Q1kJ/mol②C2H5OH(g)═C2H5OH(l)△H=-Q2kJ/mol
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3kJ/mol
下列说法正确的是( )
| A. | 酒精的燃烧热△H=(Q2-Q3-3Q1)kJ/mol | |
| B. | 由③可知1molC2H5OH(g)的能量大于2molCO2(g)和3molH2O(g)的总能量 | |
| C. | H2O(g)→H2O(l)释放出了热量,所以该过程为放热反应 | |
| D. | 23g液态酒精完全燃烧生成CO2(g)和H2O(l),放出的热量为(0.5Q2-0.5Q3-1.5Q1)kJ |
分析 A、反应热是指生成液态水时放出的热量;
B、焓变是指反应物的能量和与生成物的能量和之差,不是一部分;
C、放热反应是指化学反应;
D、据盖斯定律解答.
解答 解:A、③生成的是水蒸气,不是液态水,所以根据盖斯定律,酒精的燃烧热△H=△H=(-Q2-Q3-3Q1)kJ/mol,故A错误;
B、△H=生成物的能量和-反应物的能量和,B中少了氧气,故B错误;
C、H2O(g)→H2O(l)是物理变化,故C错误;
D、已知:①H2O(g)═H2O(l)△H=-Q1 kJ•mol-1
②C2H5OH(g)═C2H5OH(l)△H=-Q2 kJ•mol-1
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3 kJ•mol-1
据盖斯定律:③-②+①×3得:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(-Q3+Q2-3Q1)KJ/mol,23g是0.5molC2H5OH,所以释放出的热量为(0.5Q3-0.5Q2+1.5Q1)kJ,故D正确;
故选D.
点评 本题考查燃烧热、焓变、放热反应以及盖斯定律的应用,题目难度不大.

练习册系列答案
相关题目
1. 弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:
弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是HCN>H2CO3>CH3COOH>HNO2.
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)=v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸<m(H2)醋酸.
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为HCN+Na2CO3═NaCN+NaHCO3.
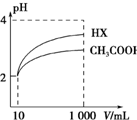
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中溶液pH变化如图所示.稀释后,HX溶液中水电离的c(H+) 比醋酸溶液中水电离的c(H+)大;电离常数Ka(HX>Ka(CH3COOH)(填“>”、“=”或“<”),理由是稀释相同倍数,较强的酸pH变化较大,较强的酸电离常数较大,从图中看出HX的pH变化较大.
 弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:
弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:| 弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
①物质的量浓度相同的四种酸,其pH由大到小的顺序是HCN>H2CO3>CH3COOH>HNO2.
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)=v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸<m(H2)醋酸.
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为HCN+Na2CO3═NaCN+NaHCO3.
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中溶液pH变化如图所示.稀释后,HX溶液中水电离的c(H+) 比醋酸溶液中水电离的c(H+)大;电离常数Ka(HX>Ka(CH3COOH)(填“>”、“=”或“<”),理由是稀释相同倍数,较强的酸pH变化较大,较强的酸电离常数较大,从图中看出HX的pH变化较大.
19.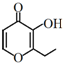 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | lmol该有机物最多能与2molH2发生加成反应 | |
| B. | 该有机物的分子式为C7H8O3 | |
| C. | 该有机物能发生取代反应、加成反应、消去反应和氧化反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
6.下列各组物质全部是弱电解质的是( )
| A. | H2SiO3.H2S CO2 | B. | H2O NH3•H2O HClO. | ||
| C. | H2SO3.Ba(OH)2BaSO4 | D. | Cu(OH)2CH3COOH CH3COONa |
16.单质铜及其化合物一般都具有特殊的颜色,如
某学校学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O,进行了认真的研究.
Ⅰ.查阅资料得出下列信息:
①Cu2O属于碱性氧化物; ②高温灼烧CuO生成Cu2O;
③Cu2O在酸性条件下能发生反应:Cu2O+2H+═Cu+Cu2++H2O.
Ⅱ.设计实验方案:
方案1:取该红色固体溶于足量的稀硝酸中,观察溶液颜色变化.
方案2:取该红色固体溶于足量的稀硫酸中,观察溶液是否呈蓝色.
方案3:称得干燥坩埚的质量为a g,取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g.
(1)写出Cu2O与稀硝酸反应的化学方程式:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O.
(2)请你评价方案1和方案2的合理性,并简述理由:
方案1:不合理,因为铜和氧化亚铜均可溶于稀硝酸形成蓝色溶液.
方案2:合理,因为氧化亚铜与稀硫酸生成Cu和Cu2+,导致溶液呈蓝色.
(3)方案3中,若确认红色固体中含有Cu2O,则a、b、c的关系为c<$\frac{9b-a}{8}$,在该实验方案中最少应进行4次称量.
Ⅲ.学习小组乙设计了新的探究方案,拟根据干燥管中无水硫酸铜是否变蓝判断红色固体中是否含有Cu2O,装置如图所示.

(4)该探究方案中检验气体发生装置气密性的方法为:关闭活塞,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置漏气;(说明操作方法、现象和结论).
(5)为确保探究的科学、合理和安全,你认为实验中还应采取的措施有ABC(填序号).
A.在氢气发生装置与硬质玻璃管之间增加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有无水硫酸铜的干燥管后再连接一个装有碱石灰的干燥管.
| Cu | Cu2O | CuO | Cu(OH)2 | CuSO4•5H2O |
| 红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |
Ⅰ.查阅资料得出下列信息:
①Cu2O属于碱性氧化物; ②高温灼烧CuO生成Cu2O;
③Cu2O在酸性条件下能发生反应:Cu2O+2H+═Cu+Cu2++H2O.
Ⅱ.设计实验方案:
方案1:取该红色固体溶于足量的稀硝酸中,观察溶液颜色变化.
方案2:取该红色固体溶于足量的稀硫酸中,观察溶液是否呈蓝色.
方案3:称得干燥坩埚的质量为a g,取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g.
(1)写出Cu2O与稀硝酸反应的化学方程式:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O.
(2)请你评价方案1和方案2的合理性,并简述理由:
方案1:不合理,因为铜和氧化亚铜均可溶于稀硝酸形成蓝色溶液.
方案2:合理,因为氧化亚铜与稀硫酸生成Cu和Cu2+,导致溶液呈蓝色.
(3)方案3中,若确认红色固体中含有Cu2O,则a、b、c的关系为c<$\frac{9b-a}{8}$,在该实验方案中最少应进行4次称量.
Ⅲ.学习小组乙设计了新的探究方案,拟根据干燥管中无水硫酸铜是否变蓝判断红色固体中是否含有Cu2O,装置如图所示.

(4)该探究方案中检验气体发生装置气密性的方法为:关闭活塞,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置漏气;(说明操作方法、现象和结论).
(5)为确保探究的科学、合理和安全,你认为实验中还应采取的措施有ABC(填序号).
A.在氢气发生装置与硬质玻璃管之间增加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有无水硫酸铜的干燥管后再连接一个装有碱石灰的干燥管.
20.工业利用冶铜炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制Fe2O3的生产流程示意图如下:
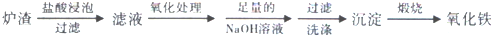
经“足量的NaOH溶液”处理后,铝元素的存在形态为( )
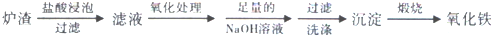
经“足量的NaOH溶液”处理后,铝元素的存在形态为( )
| A. | Al | B. | Al(OH)3 | C. | Al3+ | D. | [Al(OH)4]- |
1.在下列4种化合物:①NaHCO3 ②Al2O3 ③(NH4)2S ④CH3COONH4中,跟盐酸和氢氧化钠溶液都能反应的是( )
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
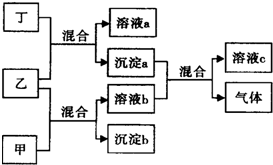 现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):
现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):