题目内容
6.甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径.由 CO2 制备甲醇过程可能涉及反应如下:反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1,回答下列问题:
(1)反应Ⅱ的△H2=+41.19 kJ•mol-1,反应 I 自发进行条件是较低温(填“较低温”、“较高温”或“任何温度”).
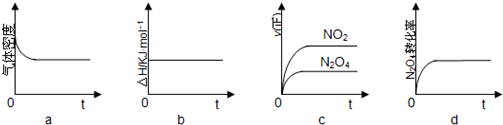
(2)在一定条件下 3L 恒容密闭容器中,充入一定量的 H2和 CO2 仅发生反应Ⅰ,实验测得反应物在不同起始投入量下,反应体系中 CO2的平衡转化率与温度的关系曲线,如图 1 所示.
①H2和 CO2的起始的投入量以 A 和 B 两种方式投入
A:n(H2)=3mol,n(CO2)=1.5mol
B:n(H2)=3mol,n(CO2)=2mol,曲线 I 代表哪种投入方式A(用 A、B 表示)
②在温度为 500K 的条件下,按照 A 方式充入 3mol H2 和 1.5mol CO2,该反应 10min 时达到平衡:
a.此温度下的平衡常数为450;500K 时,若在此容器中开始充入 0.3molH2和 0.9mol CO2、0.6molCH3OH、xmolH2O,若使反应在开始时正向进行,则 x 应满足的条件是0<x<2.025.
b.在此条件下,系统中 CH3OH 的浓度随反应时间的变化趋势如图 2 所示,当反应时间达到 3min时,迅速将体系温度升至 600K,请在图2中画出 3~10min 内容器中 CH3OH 浓度的变化趋势曲线.
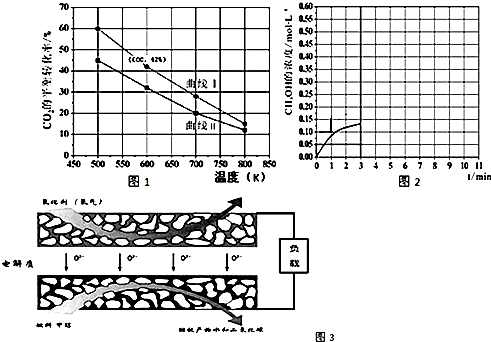
(3)固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化锆氧化钇为电解质,这种固体 电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图 3 所示,其中多孔电极均 不参与电极反应,图3是甲醇燃料电池的模型.
①写出该燃料电池的负极反应式CH3OH-6e-+3O2-=CO2↑+2H2O.
②如果用该电池作为电解装置,当有 16g 甲醇发生反应时,则理论上提供的电量最多为3mol.
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,反应自发进行的判断依据是△H-T△S<0;
(2)①图象分析相同温度下,两种反应物,增大一种物质的量会提高另一种物质的转化率;
②a.结合三行式进行计算,化学反应的平衡常数K各个生成物平衡浓度系数次方的乘积和各个反应物平衡浓度系数次方乘积的比值,据此计算;
b.3min时未到达平衡,此时迅速将体系温度升至600K,瞬间甲醇的浓度不变,反应速率加快,到达平衡的时间小于10min,而在温度为600K的条件下,充入3mol H2和1.5mol CO2,平衡时二氧化碳的转化率约是42%,则平衡时甲醇的物质的量约是1.5mol×42%=0.63mol,则平衡时甲醇的浓度约是0.21mol/L;
(3)①以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,分析该电池的工作原理如图3所示可知负极是甲烷失电子发生氧化反应,结合导电离子和电荷守恒分析书写;
②依据电极反应计算转移电子物质的量.
解答 解:(1)反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1
根据盖斯定律,反应Ⅱ可以是Ⅰ-Ⅲ得到,所以反应Ⅱ的焓变△H2=(-49.58kJ•mol-1)-(-90.77kJ•mol-1)=+41.19 kJ•mol-1;根据反应自发行的判据:△H-T△S<0,反应Ⅲ是熵减的放热的反应,所以要自发进行需要在较低温下进行,
故答案为:+41.19 kJ•mol-1;较低温;
(2)①A:n(H2)=3mol,n(CO2)=1.5mol,B:n(H2)=3mol,n(CO2)=2mol,二者比较B相当于增大二氧化碳的量,转化率小于A,所以曲线 I代表A的投料,
故答案为:A;
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡,二氧化碳的转化率是60%,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始浓度:0.5 1 0 0
变化浓度:0.3 0.9 0.3 0.3
平衡浓度:0.2 0.1 0.3 0.3
a.该温度下,反应I的平衡常数K=$\frac{0.3×0.3}{0.2×0.{1}^{3}}$=450,
500K时,若在此容器中开始充入0.3molH2和0.9mol CO2、0.6molCH3OH、xmolH2O,浓度分别为0.1mol/L,0.3mol/L,0.2mol/L,$\frac{x}{3}$mol/L
若使反应在开始时正向进行,浓度商Qc=$\frac{0.2×\frac{x}{3}}{0.3×0.{1}^{3}}$<K=450
x=2.025
则x应满足的条件是0<x<2.025
故答案为:450;0<x<2.025;
b.当反应时间达到3min时,迅速将体系温度升至600K,则平衡正向进行,甲醇的浓度会增加,3min时未到达平衡,此时迅速将体系温度升至600K,瞬间甲醇的浓度不变,反应速率加快,到达平衡的时间小于10min,而在温度为600K的条件下,充入3mol H2和1.5mol CO2,平衡时二氧化碳的转化率约是42%,则平衡时甲醇的物质的量约是1.5mol×42%=0.63mol,则平衡时甲醇的浓度约是0.21mol/L,3~10min内容器中CH3OH浓度的变化趋势曲线为:图象为,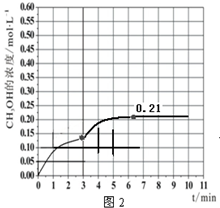 ,
,
故答案为: ;
;
(3)①以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,分析该电池的工作原理如图3所示可知负极是甲烷失电子发生氧化反应,结合导电离子和电荷守恒分析书写电极反应为:CH3OH-6e-+3O2-=CO2↑+2H2O,
故答案为:CH3OH-6e-+3O2-=CO2↑+2H2O;
②16g甲醇物质的量=$\frac{16g}{32g/mol}$=0.5mol,发生反应时电子转移0.5mol×6=3mol,
故答案为:3.
点评 本题综合考查学生盖斯定律的应用、化学反应速率的计算、化学平衡移动的影响因素等知识,属于综合知识的考查,难度较大.

 全能练考卷系列答案
全能练考卷系列答案| A. | 12C、13C和14C互为同位素,他们的放射性可用于考古断代,可测定生物体死亡的年代 | |
| B. | 合成纤维是利用自然界的纤维材料通过化学合成方法得到的 | |
| C. | 研制出性能优良的催化剂可以使反应的温度降低,从而起到很好的节能效果 | |
| D. | 碰撞理论和过度态理论是常用的化学反应速率理论,其中过渡态理论可解释温度、浓度等对化学反应速率的影响 |
| A. | 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 | |
| B. | 滴定达到终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 | |
| D. | 随着NaOH溶液的滴入,锥形瓶中的pH由小变大 |
| A. | 3.65g | B. | 7.3g | C. | 10.95g | D. | 14.6g |
| A. | 4、1、5、NO2 | B. | 4、2、4、NO2 | C. | 4、1、3、NH4NO3 | D. | 4、3、5、NO |
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |