题目内容
8.如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.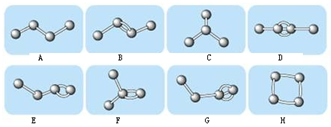
(1)图中属于烷烃的是A、C (填编号)
(2)图中属于甲烷同系物的是A、C(填编号)
(3)上图中与B互为同分异构体的是E、F、H(填编号)
分析 (1)烷烃分子中,碳原子和其他原子均以单键成键;
(2)结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
(3)分子式相同而结构不同的有机化合物互为同分异构体.
解答 解:(1)根据图示的球棍模型可以看出,只有A、C中碳原子和其他原子以共价单键结合,属于烷烃,
故答案为:A、C;
(2)只有A、C中碳原子和其他原子以共价单键结合,属于烷烃,属于甲烷同系物,
故答案为:A、C;
(3)B为2-丁烯,分子式为C4H8,E、F、H的分子式都为C4H8,且它们的结构不同,所以B与E、F、H互为同分异构体,
故答案为:E、F、H.
点评 本题考查了球棍模型、有机化合物中碳的成键特征、同分异构体等知识,题目难度不大,注意掌握对信息的理解运用、读图方法,本题能够加深对同分异构体概念的理解,培养学生灵活应用所学知识的能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
18.将乙醇1mol(其中的羟基氧用 18O 标记)在浓硫酸存在并加热下与足量乙酸充分反应.下列叙述不正确的是( )
| A. | 不可能生成90g 乙酸乙酯 | B. | 生成的乙酸乙酯中含有18O | ||
| C. | 可能生成61.6g 乙酸乙酯 | D. | 生成的水分子中一定含有18O |
19.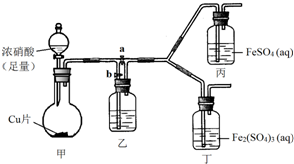 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.
(1)该同学在实验前,依据Fe2+的还原性,填写了下表.
依照表中操作,该同学进行实验.观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.
为了进一步探究溶液变成深棕色的原因,该同学进行如下实验.
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者(加了数滴浓硝酸的FeSO4溶液)变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
ⅲ.为与ⅰ中实验进行对照,更换丙、丁后(溶质不变),使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO)3+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤ⅱ的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到).
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.(1)该同学在实验前,依据Fe2+的还原性,填写了下表.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO${\;}_{3}^{-}$+2H+=Fe3++NO2↑+H2O |
为了进一步探究溶液变成深棕色的原因,该同学进行如下实验.
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者(加了数滴浓硝酸的FeSO4溶液)变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
ⅲ.为与ⅰ中实验进行对照,更换丙、丁后(溶质不变),使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO)3+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤ⅱ的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到).
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
16.某学生欲通过实验验证Fe2+的性质.
(1)该同学在实验前,依据Fe的还原性,填写了下表.
依照表中操作,该同学进行实验,观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.为探究溶液变为深棕色的原因,该同学进行了如下实验.
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)查阅资料,发现溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
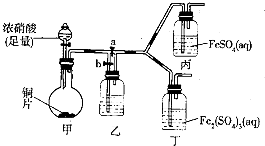
Ⅰ、打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
Ⅱ、打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ、为与I中实验对照,更换丙、丁后,使甲中反应继续,观察到的现象与步骤I中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤II的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到).
(4)该同学重新进行(1)中实验,观察到了预期现象,他的实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
(1)该同学在实验前,依据Fe的还原性,填写了下表.
| 实验操作 | 预期现象 | 离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2↑+H2O |
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)查阅资料,发现溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.

Ⅰ、打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
Ⅱ、打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ、为与I中实验对照,更换丙、丁后,使甲中反应继续,观察到的现象与步骤I中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤II的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到).
(4)该同学重新进行(1)中实验,观察到了预期现象,他的实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
3.下列各组物质在溶液中不发生化学反应而能共存的是( )
| A. | Na2SO4 KNO3 Na2CO3 NH4Cl | B. | H2SO4 BaCl2 Na2SO4 NaOH | ||
| C. | MgCl2 AgNO3 KNO3 HCl | D. | NH4HCO3 NaOH NaCl HCl |
13.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是( )
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 高温或日常用的消毒剂可使禽流感病毒蛋白质变性 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
17.对下列物质用途的描述不符合事实的是( )
| A. | 硅酸钠可用作木材防火涂料 | B. | Fe2O3可用作外墙涂料 | ||
| C. | 过氧化钠可用作潜艇供氧剂 | D. | 铝制容器可以贮运稀硝酸 |