题目内容
15.用 NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 1mol•L-1AlCl3 溶液中,含 Al3+数目小于 NA | |
| B. | 标准状况下,6.0gNO 和 2.24LO2混合,所得气体的分子数目为 0.2NA | |
| C. | 25℃,1LpH=1 的稀硫酸中含有的 H+数为 0.2NA | |
| D. | 由 1molCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为NA 个 |
分析 A.溶液体积未知;
B.标准状况下,6.0gNO和2.24LO2混合后生成的NO2中存在平衡:2NO2?N2O4;
C.25℃,pH=1 的稀硫酸中氢离子物质的量浓度为0.1mol/L;
D.由1molCH3COONa和少量CH3COOH形成的中性溶液中,根据电荷守恒来分析.
解答 解:A.溶液体积未知,无法确定铝离子数目,故A错误;
B.标准状况下,6.0gNO和2.24LO2混合后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减小,故B错误;
C.25℃,pH=1 的稀硫酸中氢离子物质的量浓度为0.1mol/L,1L溶液中含有氢离子数目为:0.1mol/L×1L×NA=0.1NA,故C错误;
D.由1molCH3COONa和少量CH3COOH形成的中性溶液中,根据电荷守恒可知:n(CH3COO-)+n(OH-)=n(H+)+n(Na+),由于溶液显中性,故有n(OH-)=n(H+),则有:n(CH3COO-)=n(Na+)=1mol,则醋酸根的个数为NA个,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,注意盐类水解的性质及溶液中电荷守恒规律的应用,难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
5.下列说法中正确的是( )
| A. | 氨气溶于水能导电,故氨气属于电解质 | |
| B. | 碳酸钡难溶于水,故碳酸钡属于弱电解质 | |
| C. | 硫酸是强电解质,故纯硫酸能导电 | |
| D. | 室温下,氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 |
3.零族元素难以形成化合物的根本原因是它们( )
| A. | 都是惰性元素 | B. | 化学性质不活泼 | ||
| C. | 都以单原子分子形式存在 | D. | 原子结构均为稳定结构 |
10.已知X+Y→M+N反应中的能量变化过程如图,则下列推断一定正确的是( )

| A. | X的能量低于M的能量 | |
| B. | Y的能量低于N的能量 | |
| C. | X和Y总能量低于M和N总能量 | |
| D. | 该反应是吸热反应,反应条件是加热 |
1.2015年10月,屠哟哟获得诺贝尔生理学或医学奖,理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率.她成为首获科学类诺贝尔奖的中国人.青蒿素两步可合成得到治疗疟疾的药物青蒿琥酯.下列有关说法正确的是( )


| A. | 青蒿素分子式为C15H2405 | |
| B. | 反应②原子利用率为100% | |
| C. | 该过程中青蒿素生成双氢青蒿素属于氧化反应 | |
| D. | 1 mol青蒿琥酯与氢氧化钠溶液反应,最多消耗1 mol氢氧化钠 |
8.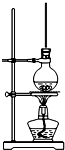 将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
(1)写出该反应的化学方程式C2H5OH+CH3COOH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(2)圆底烧瓶上方长玻璃管的作用是平衡气压,冷凝回流,圆底烧瓶中加的固体物质是沸石或碎瓷片,作用是防止暴沸.
(3)前20min生成酯的厚度比以后每20min要大,原因是开始反应物浓度大,反应速率快.
(4)若每1mm酯的质量均为0.088g,则前40min内乙醇的反应速率为0.00015mol/min.
(5)达到平衡时乙醇(密度0.78g/mL)的转化率为31.5%(保留一位小数).欲提高乙酸的转化率,可采取的措施有分离出乙酸乙酯或增加乙醇的量(写一种即可).
 将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:| 时间(min) | 20 | 40 | 60 | 80 | 100 | 120 |
| 酯的厚度(mm) | 4 | 6 | 7 | 7.5 | 8 | 8 |
(2)圆底烧瓶上方长玻璃管的作用是平衡气压,冷凝回流,圆底烧瓶中加的固体物质是沸石或碎瓷片,作用是防止暴沸.
(3)前20min生成酯的厚度比以后每20min要大,原因是开始反应物浓度大,反应速率快.
(4)若每1mm酯的质量均为0.088g,则前40min内乙醇的反应速率为0.00015mol/min.
(5)达到平衡时乙醇(密度0.78g/mL)的转化率为31.5%(保留一位小数).欲提高乙酸的转化率,可采取的措施有分离出乙酸乙酯或增加乙醇的量(写一种即可).
6.下列由实验现象得出的结论正确的是( )
| 选项 | 实验及现象 | 结论 |
| A | 向AgNO3和AgCl的浊液中滴入0.1mol/LNa2S溶液,生成黑色沉淀 | Ag2S的溶度积比AgCl的小 |
| B | 将光亮镁条放入盛有NH4Cl溶液的试管中,产生大量气泡,同时将湿润的红色石蕊试纸靠近试管口,试纸变蓝 | 反应产生的气体一定是NH3 |
| C | 向溶液X中先滴加稀硝酸,在滴加Ba(NO3)2溶液,出现白色沉淀 | 溶液X中一定含有SO42- |
| D | 将铜粉加入1.0mol/L Fe2(SO4)3溶液中,溶液变蓝 | 说明氧化性Fe3+>Cu2+ |
| A. | A | B. | B | C. | C | D. | D |