题目内容
1.如表实验操作能达到相应目的是( )| 编号 | 实验操作 | 目的 |
| A | 取4gNaOH固体溶于100mL水中 | 配制0.1mol•L-1NaOH溶液 |
| B | 向沸水中逐滴加入1-2mLFeCl3饱和溶液,搅拌并继续煮沸到变成红褐色 | 制备Fe(OH)3胶体 |
| C | 测定等物质的量浓度的盐酸、硝酸的pH | 比较Cl、N的非金属性 |
| D | 用MgCl2、AlCl3溶液做导电性试验 | 证明两者是离子化合物还是共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.n(NaOH)=$\frac{4g}{40g/mol}$=0.1mol,c=$\frac{n}{V}$中V指溶液体积而不是溶剂体积;
B.制备氢氧化铁胶体时不能搅拌且不能长时间煮沸;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,不能根据氢化物水溶液酸性强弱判断非金属性强弱;
D.熔融状态下能导电的化合物是离子化合物.
解答 解:A.n(NaOH)=$\frac{4g}{40g/mol}$=0.1mol,c=$\frac{n}{V}$中V指溶液体积而不是溶剂体积,取4gNaOH固体溶入100mL水中,溶液体积大于0.1L,所以配制溶液浓度小于1mol/L,故A错误;
B.制备氢氧化铁胶体时不能搅拌且不能长时间煮沸,否则易产生沉淀,应该将溶液煮沸至红褐色停止加热,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,不能根据氢化物水溶液酸性强弱判断非金属性强弱,所以不能根据盐酸酸性强弱判断Cl元素非金属性强弱,故C错误;
D.离子化合物是由阴阳离子构成的,熔融状态下离子化合物中含有自由移动离子而导电,所以熔融状态下能导电的化合物是离子化合物,熔融状态下不导电的化合物是共价化合物,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及非金属性强弱判断、物质制备、溶液配制、离子化合物和共价化合物判断等知识点,把握物质的性质、反应原理等为解答的关键,侧重分析与实验能力的考查,易错选项是B.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 某溶液与Na0H溶液共热.产生使湿润的石蕊试纸变红的气体,说明原溶液中存在NH${\;}_{4}^{+}$ | |
| B. | 某溶液中加人AgN03溶液时,产生白色沉淀.说明原溶液中含有Cl- | |
| C. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧时,火焰呈黄色,说明原溶液中含有金属钠 | |
| D. | 某溶液中加人BaCl2溶液时,产生白色沉淀.原溶液中可能存在Ag+或SO42-或CO32- |
9.根据下列金属的熔、沸点:其中不能形成合金的是( )
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1 083 | 660 | 1 535 |
| 沸点/℃ | 883 | 2 595 | 2 200 | 3 000 |
| A. | Cu与Na | B. | Fe与Cu | C. | Fe与Al | D. | Al与Na |
6.对表中方程式的评价正确的是( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与硝酸反应:Fe3O4+8H+ ═Fe2++2Fe3++4H2O | 书写正确 |
| B | 工业制粗硅:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | 错误,生成物应是Si和CO |
| C | NaAlO2溶液与少量CO2反应: AlO2- ̄+CO2+2H2O═HCO3- ̄+Al(OH)3↓ | 书写正确 |
| D | NaHCO3溶液中加入少量石灰水:Ca2++2OH-+2HCO-3=CaCO3↓+CO32-+2H2O | 错误,生成物 中不含CO32- |
| A. | A | B. | B | C. | C | D. | D |
11.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图:
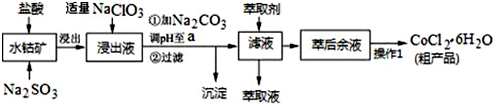
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)水钴矿进行预处理时加入Na2SO3的主要作用是将Fe3+、Co3+还原.
(2)写出NaClO3在浸出液中发生主要反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)加Na2CO3调pH至a,a的取值范围是5.2≤a≤7.6;制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
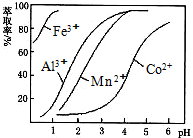
(4)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5
B.3.0~3.5
C.4.0~4.5
D.5.0~5.5
(5)CoCl2•6H2O溶解度随温度升高显著增大,所得粗产品通过重结晶方法提纯.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)水钴矿进行预处理时加入Na2SO3的主要作用是将Fe3+、Co3+还原.
(2)写出NaClO3在浸出液中发生主要反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)加Na2CO3调pH至a,a的取值范围是5.2≤a≤7.6;制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(4)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5
B.3.0~3.5
C.4.0~4.5
D.5.0~5.5
(5)CoCl2•6H2O溶解度随温度升高显著增大,所得粗产品通过重结晶方法提纯.

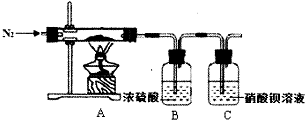 硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.
硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.