题目内容
10.某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+.为了确认溶液的组成,进行了如下实验:①取200ml,上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g.向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润的红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).关于原溶液组成的结论,不正确的是( )
| A. | C(NH4+)>C(SO42-) | |
| B. | 一定存在Cl-、SO42-、CO32-、NH4+,一定不存在Na+、K+ | |
| C. | c(CO32-)=0.05mol/L | |
| D. | 至少存在四种离子,且C(Cl-)≥0.05mol/L |
分析 ①取少量该溶液加入BaCl2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,说明白色沉淀为BaCO3和BaSO4,则溶液中含有CO32-、SO42-;
②向①的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体,说明溶液中有NH4+,由此分析解答.
解答 解:①取少量该溶液加入BaCl2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成,说明白色沉淀为BaCO3和BaSO4,质量一共是4.3g,则溶液中含有CO32-、SO42-,向沉淀中加入过量的盐酸,有2.33g沉淀不溶,则硫酸钡的质量是2.33g,所以硫酸根离子的物质的量是$\frac{2.33g}{233g/mol}$=0.01mol,所以碳酸钡的质量是4.3g-2.33g=1.97g,碳酸根离子的物质的量是$\frac{1.97g}{197g/mol}$=0.01mol;
②向①的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体是氨气,物质的量是$\frac{1.12L}{22.4L/mol}$=0.05mol,说明溶液中有NH4+的物质的量是0.05mol;综合以上分析:
A、硫酸根为0.01mol,铵根为0.05mol,故c(NH4+)>(SO42-),故A正确;
B、依据溶液电中性原则,假设都存在,那么n(+)=n(-),即0.05+n(Na+)+n(K+)=2×0.01+2×0.01+n(Cl-),据此得出n(Cl-)=n(Na+)+n(K+)+0.01>0.01,所以溶液一定存在的离子有:Cl-、CO32-、SO42-、NH4+;可能存在的离子有:K+、Na+,故B错误;
C、依据计算得出c(CO32-)=$\frac{0.01mol}{0.2L}$=0.05mol/L,故C正确;
D、依据溶液电中性原则,假设都存在,那么n(+)=n(-),即0.05+n(Na+)+n(K+)=2×0.01+2×0.01+n(Cl-),据此得出n(Cl-)=n(Na+)+n(K+)+0.01>0.01,所以c(Cl-)≥$\frac{0.01}{0.2}$=0.05mol/L,故D正确;
故选B.
点评 本题主要考查的是常见阳离子检验的综合题,有一定难度,牵涉离子的定量判断与计算.

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案| A. | 该元素一定在第三周期 | |
| B. | 该元素一定在第二周期 | |
| C. | 若该离子是阳离子,则该元素一定在第三周期 | |
| D. | 若该离子是阴离子,则该元素一定在第三周期 |
| A. | 3 v (N2)=v(H2) | B. | v (N2)=3v(H2) | C. | 1.5v (H2)=v(NH3) | D. | v (N2)=2v(NH3) |
| A. | 蔗糖 | B. | 氯化钠溶液 | C. | 熔融的氧化铝 | D. | 盐酸 |
| A. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | Ba(OH)2溶液与稀硫酸反应:Ba2++OHˉ+H++SO42-═BaSO4↓+H2O | |
| C. | CaCO3中加入稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | Mg(OH)2与盐酸反应:OHˉ+2H+═H2O |
| A. | 铜丝 | B. | MgCl2 | C. | 氨气 | D. | 蔗糖 |
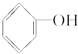 +2H2SO4(浓)$\stackrel{△}{→}$
+2H2SO4(浓)$\stackrel{△}{→}$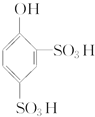
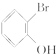 (无机试剂任选).
(无机试剂任选).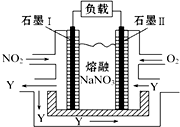 NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,石墨Ⅰ为电池的负极;该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为NO2-e-+NO3-═N2O5.
NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,石墨Ⅰ为电池的负极;该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为NO2-e-+NO3-═N2O5.