题目内容
14.下列事实中,不能用勒夏特列原理解释的是( )| A. | 对2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 | |
| B. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0升高温度使平衡向逆方向移动 | |
| C. | 合成氨反应:N2(g)+3H2(g)?2NH3(g)△H<0,为使氨的产率提高,理论上应采取低温高压的措施 | |
| D. | 在溴水中存在如下平衡:Br2(g)+H2O(l)?HBr(aq)+HBrO(aq),当加入NaOH溶液后颜色变浅 |
分析 勒夏特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒沙特列原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用勒夏特列原理解释.
解答 解:A.增大压强容器体积减小,碘浓度增大导致颜色加深,但增大压强平衡不移动,所以不能用平衡移动原理解释,故A选;
B.该反应的正反应是放热反应,升高温度平衡向吸热方向逆反应方向移动,可以用平衡移动原理解释,故B不选;
C.该反应是一个反应前后气体体积减小、放热的可逆反应,降低温度、增大压强平衡都向正反应方向移动,可以用平衡移动原理解释,故C不选;
C.NaOH和HBr、HBrO反应生成盐而促进溴和水反应,导致溴浓度降低,平衡正向移动,溶液颜色变浅,可以用平衡移动原理解释,故D不选;
故选A.
点评 本题考查化学平衡移动原理,为高频考点,侧重考查学生对化学平衡移动原理的理解和判断,只有能引起平衡移动的才能用平衡移动原理解释,易错选项是A.

练习册系列答案
相关题目
2.加强能源资源节约和生态环境保护,增强可持续发展能力.下列做法与之不相符的是( )
| A. | 防止废旧电池重金属盐对土壤水资源造成污染,大力开发废旧电池综合利用技术 | |
| B. | 为减少北方雾霾,作物秸秆禁止直接野外燃烧,研究开发通过化学反应转化为乙醇用作汽车燃料 | |
| C. | 为节约垃圾处理的费用,大量采用垃圾的填埋 | |
| D. | 为减少温室气体排放,应减少燃煤.大力发展新能源,如核能、风能、太阳能 |
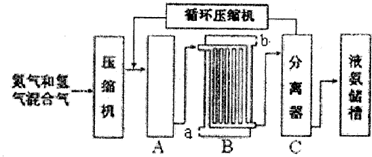
19.已知X、Y、Z、M均为中学常见单质或化合物,它们之间存在如图所示转化关系 (部分产物略去).上述转化中X可能是下列物质中的( )
X$\stackrel{M}{→}$Y$\stackrel{M}{→}$Z
①S单质 ②C单质 ③NaOH ④NH3.
X$\stackrel{M}{→}$Y$\stackrel{M}{→}$Z
①S单质 ②C单质 ③NaOH ④NH3.
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
1.利用单质铁(经过处理)处理水体砷污染的原理为:单质铁或在水体中被氧化腐蚀得到水合氧化铁[Fe(OH)3和FeOOH,可分别写为Fe2O3•3H2O和Fe2O3•H2O统称水合氧化铁],吸附沉降砷的化合物(如:含AsO33-、AsO43-等物质).
(1)写出单质铁在水体中被(O2)氧化腐蚀得到水合氧化铁(FeOOH)的化学方程式:
4Fe+3O2+2H2O=4FeOOH.
(2)某课题组通过查阅文献,进行了用相同单质铁(相同性状和相同质量)在相同时间内,对影响单质铁去除一定量水体中砷的效率的因素提出了以下假设,并进行了实验探究:
假设1:水样的pH;
假设2:水体中所含其他物质及离子;
假设3:水体中的溶解氧;
(3)其他条件相同,调节水样的pH,得到除砷效率曲线为图1,若控制水样pH=5时,测定不同时间段的除砷效率为图2:
①根据单质铁除砷原理,请解释水样酸性较强时,除砷效率较低的原因可能是酸性较强时,单质铁被腐蚀后,无法生成水合氧化铁,吸附能力下降,除砷效率降低;
②国家饮用水标准规定水中砷的含量应低于0.05mg/L(1mg=1000μg),根据图中信息判断:若控制水样的pH=6,出水后的砷浓度是否达到饮用水标准?达到.(填
“达到”、“未达到”或“无法判断”)
(4)为验证假设3,课题组成员设计了以下实验.请你完成表格中的内容(水样中砷的浓度可用分光光度计测定)

(1)写出单质铁在水体中被(O2)氧化腐蚀得到水合氧化铁(FeOOH)的化学方程式:
4Fe+3O2+2H2O=4FeOOH.
(2)某课题组通过查阅文献,进行了用相同单质铁(相同性状和相同质量)在相同时间内,对影响单质铁去除一定量水体中砷的效率的因素提出了以下假设,并进行了实验探究:
假设1:水样的pH;
假设2:水体中所含其他物质及离子;
假设3:水体中的溶解氧;
(3)其他条件相同,调节水样的pH,得到除砷效率曲线为图1,若控制水样pH=5时,测定不同时间段的除砷效率为图2:
①根据单质铁除砷原理,请解释水样酸性较强时,除砷效率较低的原因可能是酸性较强时,单质铁被腐蚀后,无法生成水合氧化铁,吸附能力下降,除砷效率降低;
②国家饮用水标准规定水中砷的含量应低于0.05mg/L(1mg=1000μg),根据图中信息判断:若控制水样的pH=6,出水后的砷浓度是否达到饮用水标准?达到.(填
“达到”、“未达到”或“无法判断”)
(4)为验证假设3,课题组成员设计了以下实验.请你完成表格中的内容(水样中砷的浓度可用分光光度计测定)
| 实验步骤 | 预期实验结果和结论 |
| ①取一定体积废水样品,分成体积相同两份,其中一份持续通入一段时间N2,以减少水中的溶解氧; | 若溶解氧不同的两份溶液中,测出的砷的浓度不同,则溶解氧对砷的去除效率有影响;反之则无影响. |
| ②向上述两份溶液中投入足量等质量的同种单质铁 | |
| ③相同一段时间后,用分光光度计测定两份水样中砷的浓度 |

2.联苄( )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
(一)催化剂的制备
下图是实验室制取少量无水AlCl3的相关实验装置的仪器和药品:

(1)将上述仪器连接成一套制备并保存无水AlCl3的装置,各管口标号连接顺序为:d接e,h接g,h接a,b接c.
(2)有人建议将上述装置中D去掉,其余装置和试剂不变,也能制备无水AlCl3.你认为这样做是否可行不可行(填“可行”或“不可行”),你的理由是制得的Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸.
(3)装置A中隐藏着一种安全隐患,请提出一种改进方案:在硬质玻璃管与广口瓶之间用粗导管连接,防止AlCl3冷凝成固体造成堵塞.
(二)联苄的制备
联苄的制取原理为:
反应最佳条件为n(苯):n(1,2-二氯乙烷)=10:1,反应温度在60-65℃之间.
实验室制取联苄的装置如下图所示(加热和加持仪器略去):

实验步骤:
在三口烧瓶中加入120.0mL苯和适量无水AlCl3,由滴液漏斗滴加10.7mL1,2-二
氯乙烷,控制反应温度在60-65℃,反应约60min.将反应后的混合物依次用稀盐酸、
2%Na2CO3溶液和H2O洗涤分离,在所得产物中加入少量无水MgSO4固体,静止、过
滤,先常压蒸馏,再减压蒸馏收集170~172℃的馏分,得联苄18.2g.
相关物理常数和物理性质如下表
(4)仪器a的名称为球形冷凝管,和普通分液漏斗相比,使用滴液漏斗的优点是可以使液体顺利滴下.
(5)洗涤操作中,水洗的目的是洗掉Na2CO3(或洗掉可溶性无机物);无水硫酸镁的作用是吸水剂(干燥剂).
(6)常压蒸馏时,最低控制温度是83.5℃.
(7)该实验的产率约为72.85%.(小数点后保留两位有效数字)
 )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:(一)催化剂的制备
下图是实验室制取少量无水AlCl3的相关实验装置的仪器和药品:

(1)将上述仪器连接成一套制备并保存无水AlCl3的装置,各管口标号连接顺序为:d接e,h接g,h接a,b接c.
(2)有人建议将上述装置中D去掉,其余装置和试剂不变,也能制备无水AlCl3.你认为这样做是否可行不可行(填“可行”或“不可行”),你的理由是制得的Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸.
(3)装置A中隐藏着一种安全隐患,请提出一种改进方案:在硬质玻璃管与广口瓶之间用粗导管连接,防止AlCl3冷凝成固体造成堵塞.
(二)联苄的制备
联苄的制取原理为:

反应最佳条件为n(苯):n(1,2-二氯乙烷)=10:1,反应温度在60-65℃之间.
实验室制取联苄的装置如下图所示(加热和加持仪器略去):

实验步骤:
在三口烧瓶中加入120.0mL苯和适量无水AlCl3,由滴液漏斗滴加10.7mL1,2-二
氯乙烷,控制反应温度在60-65℃,反应约60min.将反应后的混合物依次用稀盐酸、
2%Na2CO3溶液和H2O洗涤分离,在所得产物中加入少量无水MgSO4固体,静止、过
滤,先常压蒸馏,再减压蒸馏收集170~172℃的馏分,得联苄18.2g.
相关物理常数和物理性质如下表
| 名称 | 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
| 1,2-二氯化烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶水,可溶苯 |
| 无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水分解,微溶苯 |
| 联苄 | 182 | 0.98 | 52 | 284 | 难溶水,易溶苯 |
(5)洗涤操作中,水洗的目的是洗掉Na2CO3(或洗掉可溶性无机物);无水硫酸镁的作用是吸水剂(干燥剂).
(6)常压蒸馏时,最低控制温度是83.5℃.
(7)该实验的产率约为72.85%.(小数点后保留两位有效数字)
 某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和儿粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿点燃酒精灯加热铜丝.
某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和儿粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿点燃酒精灯加热铜丝. c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-)
c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-)