题目内容
16.对于Cu-H2SO4-Zn原电池的叙述正确的是( )| A. | 原电池是将电能直接转化成化学能的装置 | |
| B. | 比较不活泼的金属为负极,负极发生氧化反应 | |
| C. | 正极为电子流入的一极,有气泡产生 | |
| D. | 正极的电极反应式:Zn-2e-=Zn2+,溶液中SO42-向正极移动 |
分析 Cu-H2SO4-Zn原电池放电时,是将化学能直接转化成电能的装置,较活泼的金属锌作负极,较不活泼的金属铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,溶液中阳离子向正极移动,阴离子向负极移动,据此解答.
解答 解:A.原电池放电时,是将化学能直接转化成电能的装置,故A错误;
B.原电池放电时,较活泼的金属锌作负极,负极上失电子发生氧化反应,故B错误;
C.该原电池放电时,负极上失电子沿导线流向正极,溶液中氢离子在正极获得电子被还原成氢气,有气泡产生,故C正确;
D.溶液中氢离子在正极获得电子被还原成氢气,电极反应式为:2H++2e-=H2↑,溶液中阴离子向负极移动,则SO42-向负极移动,故D错误;
故选D.
点评 本题考查了原电池原理,难度不大,注意把握正负极的判断方法,难点是判断溶液中阴阳离子的移动方向.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
1.关于0.01mol•L-1NaHCO3溶液,下列说法正确的是( )
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)═2[c(H2CO3)+c(HCO3-+c(CO32-)] | |
| D. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
8.元素X和元素Y在周期表中位于相邻的两个周期,X和Y两原子核外电子总数之和为19,Y原子核内质子数比X多3个,下列叙述正确的是( )
| A. | Y不能置换出硫酸铜溶液中的铜元素 | |
| B. | X和Y形成的化合物的化学式可以为Y3X | |
| C. | X的单质与Y的单质不能反应 | |
| D. | X和Y都是性质活泼的元素,在自然界中只能以化合态存在 |
5.已知在25℃、1.0×105Pa条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ•mol-1 | B. | 2H2(g)+O2(g)=2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-242 kJ•mol-1 | D. | 2H2(g)+O2(g)=2H2O(g)△H=-484 kJ•mol-1 |
6.燃烧1g乙醇(液态)生成CO2气体和液态水放出热量为29.7KJ,则乙醇燃烧的热化学方程式正确的是( )
| A. | C2H 5OH+3O2═2CO2+3H 2O△H=-29.7 kJ/mol -1 | |
| B. | C2H 5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=+1366.2kJ/mol -1 | |
| C. | C 2 H 5 OH(l)+3O2 (g)═2CO2 (g)+3H 2O(g)△H=+29.7 kJ/mol-1 | |
| D. | C2H 5OH(l)+3O2 (g)═2CO 2 (g)+3H 2 O(l)△H=-1366.2kJ/mol -1 |
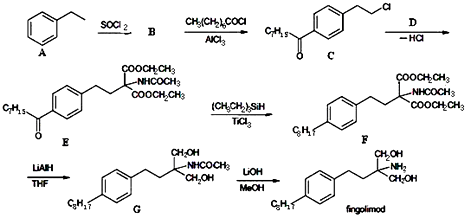
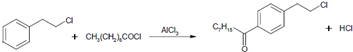 .
.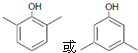 .
.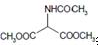 等主要原料,合成医药中间体:
等主要原料,合成医药中间体: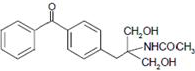 (无机原料任选).合成路线流程图示例如下:
(无机原料任选).合成路线流程图示例如下: