题目内容
5.配制一定体积、一定物质的量浓度的溶液,正确情况对实验结果产生偏低影响的是( )| A. | 容量瓶中原有少量蒸馏水 | B. | 溶解所用的烧杯未洗涤 | ||
| C. | 定容时仰视观察液面 | D. | 定容时俯视观察液面 |
分析 A.容量瓶中有少量的蒸馏水,对配制的溶液中溶质的物质的量和最终溶液体积没有影响;
B.没有洗涤烧杯和玻璃杯,配制的溶液中溶质的物质的量偏小;
C.定容时仰视容量瓶刻度线,导致加入的蒸馏水体积偏大;
D.定容时俯视容量瓶刻度线,导致加入的蒸馏水在容量瓶刻度线下方,配制的溶液体积偏小.
解答 解:A.用于定容时还需要加入蒸馏水,所以容量瓶中原有少量蒸馏水不影响配制结果,故A错误;
B.配制过程中,为了减小误差,溶解后所用烧杯必须蒸馏水洗涤,若没有洗涤烧杯,会导致溶质的物质的量偏小,配制的溶液浓度偏低,故B正确;
C.定容时观察液面仰视,加入的蒸馏水位于容量瓶刻度线上方,导致配制的溶液体积偏大,溶液浓度偏小,故C正确;
D.定容时观察液面俯视,加入的蒸馏水位于刻度线下方,配制的溶液体积偏小,配制的溶液浓度偏高,故D错误;
故选BC.
点评 本题考查了配制一定物质的量浓度方法及误差分析,题目难度中等,注意掌握配制一定浓度的溶液方法,明确误差分析的方法与技巧,试题培养了学生的化学实验能力.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
15.下列图示与对应的叙述相符的是( )
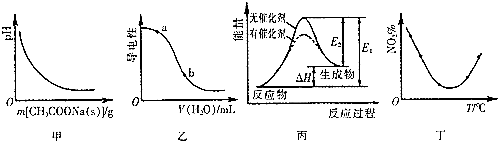

| A. | 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 | |
| B. | 图乙表示向NH3•H2O溶液中加水时溶液的导电性变化,则NH3•H2O溶液的pH:a<b | |
| C. | 图丙表示催化剂能改变化学反应的活化能 | |
| D. | 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则反应的△H>0 |
13.W、X、Y、Z是四种原子序数依次增大的短周期主族元素.W元素的最高正化合价与最低负化合价的代数和为0,X元素原子的电子层数是最外层电子数的3倍,Y元素原子M层上的电子数为6.则下列说法正确的是( )
| A. | 原子半径:Z>Y>X | |
| B. | 简单阴离子还原性:Z>Y | |
| C. | 最高价氧化物对应水化物的酸性:Z>Y | |
| D. | W与Z形成的化合物一定是易溶于水的气体 |
20.在某些火箭发射的过程中常用肼(N2H4)为燃料.0.1mol N2H4(气态)在O2(气态)中燃烧生成N2(气态)和H2O(气态),放出53.4kJ的热量.又知:H2O(g)=H2O(l)△H=-44KJ.mol-1.则下列热化学方程式正确的是( )
| A. | N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=+534 kJ•mol-1 | |
| B. | N2H4(l)+O2(g)═N2(g)+2H2O(g);△H=-534 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(l);△H=-534 kJ•mol-1 | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(l);△H=-622 kJ•mol-1 |
10.下列各组物质中,只要总质量一定,不论以何种比例混合,完全燃烧,生成的二氧化碳和水的质量也总是定值的是( )
| A. | 丙烷和丙烯 | B. | 乙烯和环丙烷 | C. | 乙炔和丁炔 | D. | 甲烷和乙烷 |
14.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 3.2 g CH30H含有的化学键数为0.4NA | |
| B. | 0.1 mol FeCl3水解制得的Fe( OH)3胶体中胶粒数是0.1NA | |
| C. | 标准状况下,2.24 L Cl2溶于足量水,转移的电子数为0.1NA | |
| D. | 0.2 g D216O中含有的质子数、中子数和电子数均为0.1NA |
15.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子NA,生成物中离子总数为2NA | |
| B. | 1LpH=2的NaHSO3溶液中,由水电离的H+数目为0.01 NA 个 | |
| C. | 1.5gCH3+里含有的电子数目为NA | |
| D. | 62g白磷中含有P_P键的数目为3NA |
 请根据所学化学反应原理,解决以下问题:
请根据所学化学反应原理,解决以下问题: