题目内容
8.如表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题.| 族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)地壳中含量最多的元素是氧(填名称);
(3)单质常用作半导体材料的是Si;
(4)Mg原子结构示意图为
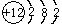 ;
;(5)O和S中,原子半径较大的是S;
(6)CH4和NH3中,热稳定性较强的是NH3(或氨气);
(7)新制氯水有漂白作用,是因为其中含有HClO(填“HCl”或“HCIO”);
(8)元素最高价氧化物对应水化物中,碱性最强的是NaOH(填化学式),两性氢氧化物是 Al(OH)3(填化学式);
(9)某烃分子中含有6个碳原子,结构简式为
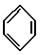 ,常用作有机溶剂.该有机物分子式为 C6H6 ,其中碳元素与氢元素的质量比m(C):m(H)=12:1(相对原子质量:H-1 C-12)
,常用作有机溶剂.该有机物分子式为 C6H6 ,其中碳元素与氢元素的质量比m(C):m(H)=12:1(相对原子质量:H-1 C-12)
分析 (1)稀有气体元素原子最外层达到稳定结构;
(2)依据各元素在地壳中含量解答;
(3)依据硅的导电性介于导体与绝缘体之间解答;
(4)镁原子核内有12个质子,核外有3个电子层,由内到外依次容纳2,8,2个电子;
(5)同主族元素从上到下原子半径依次增大;
(6)同周期元素,气态氢化物从左到右,稳定性依次增强;
(7)依据次氯酸具有强的氧化性,能够使蛋白质变性解答;
(8)依据同周期金属元素金属性从左到右依次减弱,最高价氧化物对应水化物碱性依次减弱解答;两性氢氧化物是指能与酸、碱反应,产物都只生成盐和水的氢氧化物;
(9)依据键线式结构表示方法判断碳原子、氢原子个数,据此书写分子式,计算碳元素与氢元素质量之比.
解答 解:(1)元素周期表中,稀有气体元素原子最外层达到稳定结构,所以化学性质最不活泼;
故答案为:Ne;
(2)地壳中含量较多的元素顺序为:氧、硅、铝、铁、钙、钠、钾等,所以含量最多的元素为氧元素,
故答案为:氧;
(3)硅的导电性介于导体与绝缘体之间,是良好的半导体材料;
故答案为:Si;
(4)镁原子核内有12个质子,核外有3个电子层,由内到外依次容纳2,8,2个电子,原子结构示意图为: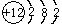 ;
;
故答案为: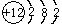 ;
;
(5)氧与硫属于同主族元素,周期表中硫在氧的下方,所以硫原子半径大于氧原子半径;
故答案为:S;
(6)同周期元素,气态氢化物从左到右,稳定性依次增强,N位于C右边,所以氨气稳定性强于甲烷;
故答案为:NH3;
(67氯水中含有次氯酸,次氯酸具有强的氧化性,能够使蛋白质变性,具有杀菌消毒作用;
故答案为:HClO;
(8)钠、镁、铝为与同周期,同周期金属元素金属性从左到右依次减弱,最高价氧化物对应水化物碱性依次减弱,所以三种金属中氢氧化钠碱性最强;氢氧化铝与酸、碱反应都只生成盐和水,属于两性氢氧化物;
故答案为:NaOH Al(OH)3;
(9) 中含有6个碳原子,依据碳原子四价键理论可知,每个碳原子都连有1个氢原子,所以分子式为C6H6,其中碳元素与氢元素的质量比m(C):m(H)=6×12g/mol:1g/mol×6=12:1;
中含有6个碳原子,依据碳原子四价键理论可知,每个碳原子都连有1个氢原子,所以分子式为C6H6,其中碳元素与氢元素的质量比m(C):m(H)=6×12g/mol:1g/mol×6=12:1;
故答案为:C6H6;12:1.
点评 本题考查了元素周期表和元素周期律的综合应用,熟悉元素在周期表中的位置、明确元素性质的递变规律是解本题关键,题目难度不大.

 出彩同步大试卷系列答案
出彩同步大试卷系列答案 甲是一种太阳能电池的工作原理示意图,电解质为K3[Fe(CN)6]和K4[Fe(CN)6]的混合溶液,将甲装置和乙装置相连实现铁件上镀铜.下列说法正确的是( )
甲是一种太阳能电池的工作原理示意图,电解质为K3[Fe(CN)6]和K4[Fe(CN)6]的混合溶液,将甲装置和乙装置相连实现铁件上镀铜.下列说法正确的是( )| A. | 电池工作时,K+移向电极a | |
| B. | 电极b表面发生的电极反应Fe(CN)64--e-═Fe(CN)63- | |
| C. | Cu电极应与Y相连接,发生氧化反应 | |
| D. | 工作一段时间后,甲乙两装置中电解质溶液浓度均变小 |
| A. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| B. | 生活中常见金属镁、铝、铁、铜等均能通过热还原法冶炼 | |
| C. | 胶体具有介稳性,是因为同种胶体粒子的运动有规律,即布朗运动 | |
| D. | 由于2NO+2CO?2CO2+N2的△H<0,则该反应一定能自发进行 |
| A. | CH3CH2CH3 | B. | CH3CH2CH2CH3 | C. | CH3COCH2CH3 | D. |  |
| A. | 建筑要使用大量的沙,常使用内陆河的河沙及海洋的海沙 | |
| B. | 含次氯酸盐的漂白粉与含盐酸的洁厕灵混合使用会产生有毒气体 | |
| C. | 漂白粉和明矾都常用于自来水的处理,二者的作用和原理不相同 | |
| D. | 绿色化学的核心是从源头上减少和消除化工生产对环境的污染 |