题目内容
 按要求完成下列问题:
按要求完成下列问题:(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ?mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=-247.4kJ?mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
(3)已知白磷、红磷燃烧的热化学方程式分别为:
P4(s,白磷)+5O2=P4O10(s);△H=-2986kJ?mol-1
4P(s,红磷)+5O2=P4O10(s);△H=-2956kJ?mol-1
则白磷比红磷
(4)已知一定条件下A2与B2自发反应生成AB3,则反应A2(g)+3B2(g)=2AB3(g) 的△S=
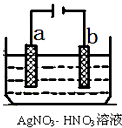
(5)如图为电解精炼银的示意图,
考点:原电池和电解池的工作原理,热化学方程式,电解原理
专题:基本概念与基本理论
分析:(1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,题干所给量计算32g甲醇燃烧生成二氧化碳和液态水放热,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;碱性燃料电池中,甲醇在负极失电子生成碳酸根离子;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)根据物质的总能量与反应热的关系判断,能量越高物质越不稳定;
(4)反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行;据此判断;
(5)电解精炼时,含有杂质的金属作阳极;若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮.
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)根据物质的总能量与反应热的关系判断,能量越高物质越不稳定;
(4)反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行;据此判断;
(5)电解精炼时,含有杂质的金属作阳极;若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮.
解答:
解:(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为725.76KJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ?mol-1,碱性燃料电池中,甲醇在负极失电子生成碳酸根离子,其电极方程式为CH3OH-6e-+8OH-═CO32-+6H2O;
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ?mol-1;CH3OH-6e-+8OH-═CO32-+6H2O;
(2)①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ?mol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ?mol-1
①×2-②得到CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=206.2×2-(-247.4)=+659.8kJ?mol-1 ;
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+659.8kJ?mol-1;
(3)已知白磷、红磷燃烧的热化学方程式分别为:
P4(s,白磷)+5O2=P4O10(s);△H=-2986kJ?mol-1
4P(s,红磷)+5O2=P4O10(s);△H=-2956kJ?mol-1
等质量的白磷和红磷完全燃烧,白磷放出的热量多,相同的状况下,白磷的能量比红磷高,则白磷比红磷不稳定,
故答案为:不稳定;
(4)已知一定条件下A2与B2自发反应生成AB3,则反应A2(g)+3B2(g)=2AB3(g),该反应正方向为物质的量减小的方向,则△S<0,一定条件下能自发进行,则
△H-T△S<0,所以<0,
故答案为:<;<;
(5)电解精炼时,粗银作阳极,纯银作阴极,所以a极为含有杂质的粗银,若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮,电极反应式为:2H++NO3-+e-=NO2↑+H2O,
故答案为:a;2H++NO3-+e-=NO2↑+H2O.
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(2)①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ?mol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ?mol-1
①×2-②得到CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=206.2×2-(-247.4)=+659.8kJ?mol-1 ;
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+659.8kJ?mol-1;
(3)已知白磷、红磷燃烧的热化学方程式分别为:
P4(s,白磷)+5O2=P4O10(s);△H=-2986kJ?mol-1
4P(s,红磷)+5O2=P4O10(s);△H=-2956kJ?mol-1
等质量的白磷和红磷完全燃烧,白磷放出的热量多,相同的状况下,白磷的能量比红磷高,则白磷比红磷不稳定,
故答案为:不稳定;
(4)已知一定条件下A2与B2自发反应生成AB3,则反应A2(g)+3B2(g)=2AB3(g),该反应正方向为物质的量减小的方向,则△S<0,一定条件下能自发进行,则
△H-T△S<0,所以<0,
故答案为:<;<;
(5)电解精炼时,粗银作阳极,纯银作阴极,所以a极为含有杂质的粗银,若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮,电极反应式为:2H++NO3-+e-=NO2↑+H2O,
故答案为:a;2H++NO3-+e-=NO2↑+H2O.
点评:本题考查了化学反应与能量、盖斯定律的应用、燃料电池电极方程式的书写、反应自发性的判断、电解原理的应用等,题目涉及的知识点较多,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列事实中不能用勒夏特列原理来解释的是( )
| A、在合成氨工业中不断补充N2和H2并将生成的NH3及时地从混合气中分离出来 |
| B、合成氨的反应需要加入催化剂 |
| C、增大压强有利于合成氨的反应 |
| D、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
既能发生加氢反应,又能发生皂化反应的是( )
| A、植物油 | B、甘油 |
| C、油酸 | D、软脂酸 |
如图是两幅微观示意图,揭示了化学变化的微观实质.下列说法中正确的是( )
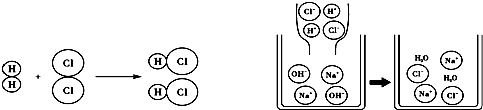

| A、该图可说明所有物质都是由分子构成的 |
| B、以上图示中未涉及置换反应 |
| C、两幅图表示的都是化合反应 |
| D、原子在化学变化中是可以再分的 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、常温常压下,1.06gNa2CO3含有的Na+离子数为0.02 NA |
| B、标准状况下,0.5 mol/LBaCl2溶液中含有Cl-离子数为NA |
| C、通常状况下,NA个CO2分子占有的体积为22.4L |
| D、2.7g铝与盐酸完全反应失去0.2NA个电子 |
 在一定温度下,向容积不变的容器中加入2mol N2、8mol H2及固体催化剂,使之反应.已知:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ?mol-1.平衡时,容器内气体压强为起始时的80%.
在一定温度下,向容积不变的容器中加入2mol N2、8mol H2及固体催化剂,使之反应.已知:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ?mol-1.平衡时,容器内气体压强为起始时的80%.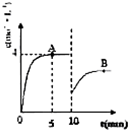 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为: