题目内容
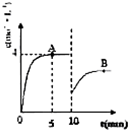 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.
(1)反应到5min时,氢气反应速率
(2)在10min时采取的措施是
(3)若合成塔内生成17g氨气放出45.5kJ热量,写出合成氨反应的热化学方程式
(4)-50°C时,液氨存在如下电离:2NH3?NH4++NH-2,K=2×10-12,往液氨中加入NH4Cl固体,K
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素
专题:化学平衡专题
分析:(1)由图可知,反应到5min时达平衡状态,氨气的浓度为4mol/L,根据v=
计算v(NH3),再利用速率之比等于化学计量数之比计算v(H2);
根据三段式计算平衡时各组分的浓度,代入平衡常数k=
计算;
(2)由图可知,10min瞬间改变条件,NH3的浓度为原平衡的一半,随后氨气的浓度增大,改变条件平衡向生成氨气的方向移动,应该是移走氨气的物质的量,降低氨气的浓度;
(3)若合成塔内生成17g氨气放出45.5kJ热量,34g氨气生成放热91KJ,标注物质聚集状态和对应反应焓变写出合成氨反应的热化学方程式;
(4)电离平衡常数只受温度影响,温度不变,电离平衡常数不变,离子浓度无关.
| △c |
| △t |
根据三段式计算平衡时各组分的浓度,代入平衡常数k=
| c2(NH3) |
| c(N2)c3(H2) |
(2)由图可知,10min瞬间改变条件,NH3的浓度为原平衡的一半,随后氨气的浓度增大,改变条件平衡向生成氨气的方向移动,应该是移走氨气的物质的量,降低氨气的浓度;
(3)若合成塔内生成17g氨气放出45.5kJ热量,34g氨气生成放热91KJ,标注物质聚集状态和对应反应焓变写出合成氨反应的热化学方程式;
(4)电离平衡常数只受温度影响,温度不变,电离平衡常数不变,离子浓度无关.
解答:
解:(1)由图可知,反应到5min时达平衡状态,氨气的浓度为4mol/L,故v(NH3)=
=0.8mol/(L?min),速率之比等于化学计量数之比,
故v(H2)=
v(NH3)=
×0.8mol/(L?min)=1.2mol/(L?min),
N2+3H2?2NH3,
开始(mol/L):a b 0
变化(mol/L):2 6 4
平衡(mol/L):a-2 b-6 4
故平衡常数k=
=
=
;
故答案为:1.2mol/(L?min);
;
(2)由图可知,10min瞬间改变条件,NH3的浓度为原平衡的一半,随后氨气的浓度增大,改变条件平衡向生成氨气的方向移动,应该是移走氨气的物质的量,降低氨气的浓度,
故答案为:移走生成的氨气,降低氨气的浓度;
(3)塔内生成17g氨气放出45.5kJ热量,34g氨气生成放热91KJ,标注物质聚集状态和对应反应焓变写出合成氨反应的热化学方程式为:N2(g)+3H2=2NH3(g)△H=-91KJ/mol;
故答案为:N2(g)+3H2=2NH3(g)△H=-91KJ/mol
(4)电离平衡常数只受温度影响,温度不变,电离平衡常数不变,离子浓度无关,故答案为:=.
| 4mol/L |
| 5min |
故v(H2)=
| 3 |
| 2 |
| 3 |
| 2 |
N2+3H2?2NH3,
开始(mol/L):a b 0
变化(mol/L):2 6 4
平衡(mol/L):a-2 b-6 4
故平衡常数k=
| c2(NH3) |
| c(N2)c3(H2) |
| 42 |
| (a-2)(b-6)3 |
| 16 |
| (a-2)(b-6)3 |
故答案为:1.2mol/(L?min);
| 16 |
| (a-2)(b-6)3 |
(2)由图可知,10min瞬间改变条件,NH3的浓度为原平衡的一半,随后氨气的浓度增大,改变条件平衡向生成氨气的方向移动,应该是移走氨气的物质的量,降低氨气的浓度,
故答案为:移走生成的氨气,降低氨气的浓度;
(3)塔内生成17g氨气放出45.5kJ热量,34g氨气生成放热91KJ,标注物质聚集状态和对应反应焓变写出合成氨反应的热化学方程式为:N2(g)+3H2=2NH3(g)△H=-91KJ/mol;
故答案为:N2(g)+3H2=2NH3(g)△H=-91KJ/mol
(4)电离平衡常数只受温度影响,温度不变,电离平衡常数不变,离子浓度无关,故答案为:=.
点评:本题考查化学反应速率计算、平衡常数有关计算与影响因素、化学平衡图象与影响因素、等效平衡、反应热的有关计算等,题目综合性较大,难度中等.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
下列体系加压后,对化学反应速率没有影响的是( )
| A、2SO2+O2═2SO3 |
| B、CO+H2O═CO2+H2 |
| C、CO2+H2O═H2CO3 |
| D、NaOH+HCl=NaCl+H2O |
在下列过程中,需要加快化学反应速率的是( )
| A、塑料老化 | B、炼钢 |
| C、钢铁生锈 | D、食物腐败 |
下列说法中能说明合成氨反应I2+H2?2HI,达到平衡状态的是( )
| A、有1个 I-I键断裂,同时有1个H-H键形成 |
| B、有1个 I-I键断裂,同时有1个H-H键断裂 |
| C、有1个 I-I键断裂,同时有1个H-I键断裂 |
| D、有1个 I-I键断裂,同时有2个H-I键形成 |
对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述中正确的是( )
| A、化学反应速率的关系是2v正(NH3)=3v正(H2O) |
| B、当4v正(O2)=5v逆(NO)时,该反应达到化学平衡状态 |
| C、若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| D、达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大 |
 按要求完成下列问题:
按要求完成下列问题: