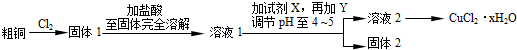题目内容
16.在密闭容器中充入4molSO2和3molO2,一定条件下建立如下平衡:2SO2(g)+O2(g)?2SO3(g)△H=-QKJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为(KJ)( )| A. | 2Q | B. | Q | C. | 1.8Q | D. | 0.9Q |
分析 测得SO2的转化率为90%,则转化的SO2为4mol×90%=3.6mol,反应中物质的量与热量成正比,以此来解答.
解答 解:测得SO2的转化率为90%,则转化的SO2为4mol×90%=3.6mol,
由2SO2(g)+O2(g)?2SO3(g)△H=-QKJ/mol可知2molSO2完全反应放出热量为QKJ,
则在此条件下反应放出的热量为$\frac{3.6}{2}$×QKJ=1.8QKJ,
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握参加反应的物质的量、物质的量与热量的关系为解答的关键,侧重分析与计算能力的考查,注意热化学方程式的意义,题目难度不大.

练习册系列答案
相关题目
6.实验室制乙酸乙酯得主要装置如图A所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯.
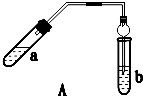
请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑.
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用是防止倒吸,步骤⑤中分离乙酸乙酯必须使用的一种仪器是分液漏斗.
(3)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图A所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管b再测有机层的厚度,实验记录如下:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol•L-1.
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸可以吸收酯化反应中生成的水,降低了生成物浓度使平衡向生成乙酸乙酯的方向移动.
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是大量乙酸、乙醇未经反应就脱离反应体系(或温度过高发生其他反应).
④分离出乙酸乙酯层后,经过洗涤,为了干燥乙酸乙酯可选用的干燥剂为B(填字母).
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体.

请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑.
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用是防止倒吸,步骤⑤中分离乙酸乙酯必须使用的一种仪器是分液漏斗.
(3)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图A所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管b再测有机层的厚度,实验记录如下:
| 实验 编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
| A | 3 mL乙醇、2 mL乙酸、1mL 18mol•L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
| C | 3 mL乙醇、2 mL乙酸、6 mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸可以吸收酯化反应中生成的水,降低了生成物浓度使平衡向生成乙酸乙酯的方向移动.
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是大量乙酸、乙醇未经反应就脱离反应体系(或温度过高发生其他反应).
④分离出乙酸乙酯层后,经过洗涤,为了干燥乙酸乙酯可选用的干燥剂为B(填字母).
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体.
4.根据热化学方程式(101kPa) S(s)+O2 (g)═SO2 (g)△H=-297.23kJ/mol 分析下列说法不正确的是( )
| A. | S的燃烧热为△H=-297.23kJ/mol | |
| B. | S(s)→S(g) 吸收热量 | |
| C. | S(g)+O2 (g)═SO2 (g) 放出的热量小于297.23kJ | |
| D. | 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量 |
11.溴化钙在医药上用作中枢神经抑制药,实验室用“尿素法”制备溴化钙的主要流程如下:
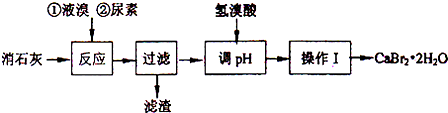
溴化钙的部分溶解度数值如下:
(1)6Ca(OH)2+6Br2 $\frac{\underline{\;50-70℃\;}}{\;}$ 5CaBr2+6H2O+Ca(BrO3)2,每生成1mol Ca(BrO3)2转移电子的物质的量为10mol;50~70℃时,尿素[CO(NH2)2]将生成的Ca(BrO3)2还原为CaBr2,尿素被氧化为N2,该反应的化学方程式为2CO(NH3)2+Ca(BrO3)2$\stackrel{50-70℃}{→}$CaBr2+2CO2↑+2N2↑+4H2O.
(2)过滤所需的玻璃仪器有玻璃棒、烧杯、漏斗.
(3)加入氢溴酸调pH的作用是除去过量的氢氧化钙.
(4)操作I包括蒸发浓缩、冷却结晶、过滤、冰水洗涤、干燥.
(5)“二氧化硫法”制备的氢溴酸粗品中常含有少量的溴和硫酸;请选用所提供的试剂,试写出检验氢溴酸粗品中是否含有SO42-的实验方案:取少量氢溴酸粗产品与试管中,滴加少量稀盐酸,再加入BaCl2溶液,若产生白色沉淀,说明含有SO42-;否则不含SO42-.

溴化钙的部分溶解度数值如下:
| 温度 | 0℃ | 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| 溶解度(g) | 125 | 132 | 143 | 213 | 278 | 295 | 312 |
(2)过滤所需的玻璃仪器有玻璃棒、烧杯、漏斗.
(3)加入氢溴酸调pH的作用是除去过量的氢氧化钙.
(4)操作I包括蒸发浓缩、冷却结晶、过滤、冰水洗涤、干燥.
(5)“二氧化硫法”制备的氢溴酸粗品中常含有少量的溴和硫酸;请选用所提供的试剂,试写出检验氢溴酸粗品中是否含有SO42-的实验方案:取少量氢溴酸粗产品与试管中,滴加少量稀盐酸,再加入BaCl2溶液,若产生白色沉淀,说明含有SO42-;否则不含SO42-.
1.氢气和氟气混合在黑暗处即可发生爆炸而释放出大量的热量.在反应过程中,断裂1molH2中的化学键消耗的能量为Q1kJ,断裂1molF2中的化学键消耗的能量为Q2kJ,形成1molHF中的化学键释放的能量为Q3kJ.下列关系式中正确的是( )
| A. | Q1+Q2<2Q3 | B. | Q1+Q2>2Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2>Q3 |
6.关于某无色溶液中所含离子的鉴别,下列判断正确的是( )
| A. | 加入BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中有SO42- | |
| B. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| D. | 加入NaOH溶液有白色沉淀出现,则原溶液中一定含有Mg2+ |