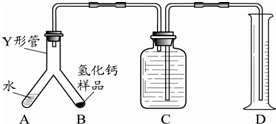
题目内容
7.氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2•2H2O),已知氯化铜易溶于水,难溶于乙醇.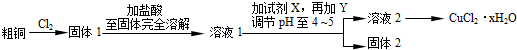
(1)为了更完全的沉淀,最适合的X试剂为C.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)溶液1中的金属离子有Fe3+、Fe2+、Cu2+.能检验溶液1中Fe2+的最合适的试剂①②(填编号)
①KMnO4 ②K3[Fe(CN)6]③NaOH ④KSCN
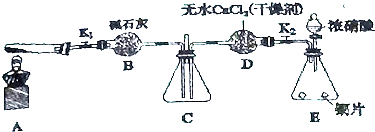
(3)实验室采用如图所示的装置,可将粗铜与Cl2反应转化为固体1(部分加热和夹持装置已略去).
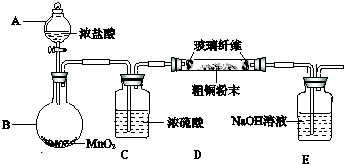
①实验所需480mL10mol/L浓HCl配制时用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、500mL容量瓶.
②引发B中反应的正确的操作顺序是打开分液漏斗上口玻璃塞,旋开分液漏斗活塞,缓慢滴加,并用酒精灯加热B装置.
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要否(填“是”或“否”).
(4)实验结束时,B和D处酒精灯应先熄灭的是D.
(5)该装置存在缺陷,请写出:缺少防止倒吸装置安全瓶.
(6)①得到CuCl2•xH2O晶体最好采用的干燥方式是D.
A.空气中加热蒸干 B.空气中低温蒸干
C.HCl气流中加热烘干 D.HCl气流中低温烘干
②为了测定制得的氯化铜晶体(CuCl2•xH2O)中x的值,某兴趣小组设计了以下实验方案:称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得黑色固体的质量为ng.沉淀洗涤的操作方法是向过滤器中加入水至完全浸没沉淀,过滤,重复2~3次.
分析 粗铜中含有Fe,与氯气反应生成CuCl2和FeCl3,为防止水解,应加入过量的稀盐酸进行溶解,并保证金属完全反应,溶液1中的金属离子有Fe3+、Fe2+、Cu2+,加入试剂X目的是将溶液中Fe2+氧化为Fe3+,应为H2O2,还原得到水,是绿色氧化剂,通过调节pH,使溶液中Fe3+转化为Fe(OH)3沉淀,过滤分离,且加入Y可以消耗氢离子且不能引入新杂质,可以为CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3.滤液经过加热浓缩、冷却结晶、过滤、洗涤、干燥得到CuCl2•2H2O,
(1)加入试剂X目的是将溶液中Fe2+氧化为Fe3+,且不引入新的杂质最好应为H2O2;
(2)Fe2+具有还原性,可以使酸性高锰酸钾溶液褪色;能与K3[Fe(CN)6]反应得到蓝色铁氰化亚铁蓝色沉淀;
(3)①实验所需480mL10mol/L浓HCl配制时用到的玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管、500mL容量瓶;
②引发B中反应的操作是:打开分液漏斗上口玻璃塞,旋开分液漏斗活塞,缓慢滴加,并用酒精灯加热B装置;
③由于HCl不影响氯气和粗铜的反应的产物,且可以抑制氯化铜水解,氯气中混有的HCl不需要除去;
(4)防止E中溶液倒吸,发生危险;
(5)该装置缺少防止倒吸装置,在D、E之间添加防倒吸的安全瓶;
(6)①CuCl2•xH2O晶体加热容易分解,且氯化铜易水解,应在HCl气流中低温烘干;
②氯化铜溶液中加入足量氢氧化钠溶液、过滤得到沉淀为氢氧化铜,沉淀洗涤的操作方法是:向过滤器中加入水至完全浸没沉淀,过滤,重复2~3次;
解答 解:(1)加入试剂X目的是将溶液中Fe2+氧化为Fe3+,X应为H2O2,还原得到水,是绿色氧化剂,A.K2Cr2O7、B.NaClO、D.KMnO4 能氧化亚铁离子为铁离子,但都会引入新的杂质,故选C,
故答案为:C;
(2)①Fe2+具有还原性,可以使酸性高锰酸钾溶液褪色,用高锰酸钾溶液可以检验Fe2+,故①正确;
②Fe2+能与K3[Fe(CN)6]反应得到蓝色铁氰化亚铁蓝色沉淀,故②正确;
③铁离子、铜离子均与NaOH反应生成沉淀,影响亚铁离子检验,故③错误;
④铁离子与KSCN反应,溶液呈红色,不能检验Fe2+,故④错误;
故答案为:①②;
(3)①实验所需480mL10mol/L浓HCl配制时用到的玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管、500mL容量瓶,
故答案为:量筒、烧杯、玻璃棒、胶头滴管、500mL容量瓶;
②引发B中反应的操作是:打开分液漏斗上口玻璃塞,旋开分液漏斗活塞,缓慢滴加,并用酒精灯加热B装置;装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水,反应离子方程式为:+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:打开分液漏斗上口玻璃塞,旋开分液漏斗活塞,缓慢滴加,并用酒精灯加热B装置;
③HCl对反应没有影响,且可以抑制氯化铜水解,不需要在浓硫酸洗气瓶前增加吸收HCl的装置,
故答案为:否;
(4)应先熄灭D处酒精灯,后熄灭B处酒精灯,防止E中溶液倒吸,发生危险,故
答案为:D;
(5)该装置缺少防止倒吸装置,在D、E之间添加防倒吸的安全瓶,
故答案为:缺少防止倒吸装置安全瓶;
(6)①CuCl2•xH2O晶体加热容易分解,且氯化铜易水解,应在HCl气流中低温烘干,
故答案为:D;
②氯化铜溶液中加入足量氢氧化钠溶液、过滤得到沉淀为氢氧化铜,沉淀洗涤的操作方法是:向过滤器中加入水至完全浸没沉淀,过滤,重复2~3次,
故答案为:向过滤器中加入水至完全浸没沉淀,过滤,重复2~3次.
点评 本题考查化学工艺流程及实验制备,涉及对实验装置与操作及试剂的分析评价、物质分离提纯、化学平衡移动、化学计算等,要求学生具备扎实的基础与综合运用能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案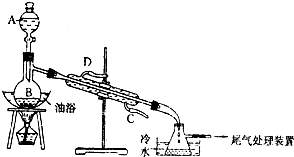 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有无水乙醇和冰醋酸.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有无水乙醇和冰醋酸.已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
②有关有机物的沸点如表所示:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.(2)用过量乙醇的主要目的是增加一种反应物,有利于酯化反应正向进行.
(3)冷凝管的主要作用是将产物冷凝,则水应从冷凝管的C(填“C”或“D”)端进入.
(4)锥形瓶中收集到的液体的主要成分是乙酸乙酯,为了得到比较纯净的该物质,常用饱和Na2CO3溶液对粗产品进行洗涤,其目的是除去乙酸乙酯中的乙酸和乙醇.如果用NaOH浓溶液代替Na2CO3溶液将引起的后果是导致乙酸乙酯水解.
(5)锥形瓶中液体经饱和碳酸钠溶液洗涤后,加入无水氯化钙,除去乙醇;再加入(此空从下列选项中选择)C,然后进行蒸馏,收集77℃左右的馏分即可.
A.五氧化二磷B.碱石灰C.无水硫酸钠D.生石灰.

已知:部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
(2)将第①步过滤所得的MnO2与KClO3、KOH溶液共热,可得到K2MnO4和KCl,此反应的化学方程式是3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O.
(3)步骤③灼烧所需的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳.
(4)“纳米铁”在空气中受撞击时会燃烧,其反应与铁在纯氧中燃烧相同,写出该反应的化学方程式3Fe+2O2$\frac{\underline{\;撞击\;}}{\;}$Fe3O4.
| A. | 2Q | B. | Q | C. | 1.8Q | D. | 0.9Q |
| A. | 是否为大量分子和离子的集合体 | B. | 能否通过滤纸或半透膜 | ||
| C. | 分散质粒子的大小 | D. | 是否均一、稳定、透明 |
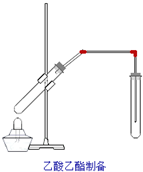 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验