题目内容
1.氢气和氟气混合在黑暗处即可发生爆炸而释放出大量的热量.在反应过程中,断裂1molH2中的化学键消耗的能量为Q1kJ,断裂1molF2中的化学键消耗的能量为Q2kJ,形成1molHF中的化学键释放的能量为Q3kJ.下列关系式中正确的是( )| A. | Q1+Q2<2Q3 | B. | Q1+Q2>2Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2>Q3 |
分析 由信息可知,H2(g)+F2(g)=2HF(g)△H<0,结合焓变等于反应物中键能之和减去生成物中键能之和,以此来解答.
解答 解:由信息可知,H2(g)+F2(g)=2HF(g)△H<0,
由焓变等于反应物中键能之和减去生成物中键能之和,
则Q1kJ/mol+Q2kJ/mol-2×Q3kJ/mol=△H,
即Q1kJ/mol+Q2kJ/mol-2×Q3kJ/mol<0,
可知Q1+Q2<2Q3,
故选A.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、键能与焓变的关系为解答的关键,侧重分析与应用能力的考查,注意判断物质中的化学键数目,题目难度不大.

练习册系列答案
相关题目
9.下列说法错误的是( )
| A. | 2NH3(g)═N2(g)+3H2(g)是熵增的反应 | |
| B. | △H、△S分别取“负”时反应一定能自发进行 | |
| C. | 在醋酸溶液中存在两种分子 | |
| D. | 相同温度下,pH值相等的盐酸和醋酸,其浓度是醋酸大于盐酸 |
16.在密闭容器中充入4molSO2和3molO2,一定条件下建立如下平衡:2SO2(g)+O2(g)?2SO3(g)△H=-QKJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为(KJ)( )
| A. | 2Q | B. | Q | C. | 1.8Q | D. | 0.9Q |
6.亚硝酸盐是一种工业盐,外观与食盐非常相似,毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:
(一)鉴别NaCl和NaNO2
甲同学用沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10.分别向盛有5mL 0.0001mol/L两种盐溶液的试管中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是盛有NaCl溶液的试管.
乙同学测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性.该溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).
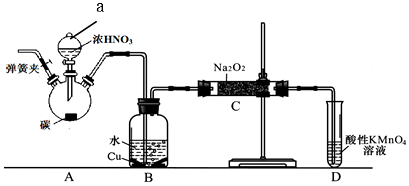
(二)该小组用如下装置(略去夹持仪器)制备亚硝酸钠
已知:①2NO+Na2O2=2NaNO2;
②酸性条件下,NO和NO2都能与MnO4- 反应生成NO3-和Mn2+
(1)使用铜丝的优点是可以控制反应的发生与停止.
(2)装置A中反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.装置C 中盛放的药品是C;(填字母代号)
A.浓硫酸 B.NaOH 溶液 C.水 D.四氯化碳
仪器F的作用防止水蒸气进入.
(3)该小组称取5.000g制取的样品溶于水配成250.0mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
①第一次实验数据出现异常,造成这种异常的原因可能是bc(填字母代号).
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O.
③该样品中亚硝酸钠的质量分数为69.0%.
(一)鉴别NaCl和NaNO2
甲同学用沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10.分别向盛有5mL 0.0001mol/L两种盐溶液的试管中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是盛有NaCl溶液的试管.
乙同学测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性.该溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).
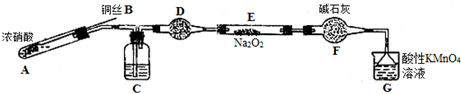
(二)该小组用如下装置(略去夹持仪器)制备亚硝酸钠

已知:①2NO+Na2O2=2NaNO2;
②酸性条件下,NO和NO2都能与MnO4- 反应生成NO3-和Mn2+
(1)使用铜丝的优点是可以控制反应的发生与停止.
(2)装置A中反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.装置C 中盛放的药品是C;(填字母代号)
A.浓硫酸 B.NaOH 溶液 C.水 D.四氯化碳
仪器F的作用防止水蒸气进入.
(3)该小组称取5.000g制取的样品溶于水配成250.0mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.70 | 20.12 | 20.00 | 19.88 |
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O.
③该样品中亚硝酸钠的质量分数为69.0%.
11.在一个密闭的容器中,含有甲烷1.6g和氧气8.0g.燃烧反应完全后,则容器中所含的分子总物质的量为多少mol( )
| A. | 0.20 | B. | 0.25 | C. | 0.30 | D. | 0.35 |